サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報
研究・研究者
研究グループ詳細
グループリーダー

新規な機能を有する金属タンパク質の構造と機能
金属タンパク質、センサータンパク質、ヘムタンパク質、ヘム
遷移金属イオンや遷移金属含有補欠分子族を活性中心とする金属タンパク質は、生物の物質代謝やエネルギー代謝において中心的な役割を果たしているのみならず、細胞内情報伝達にも深く関わっていることが知られています。生物は様々な外部環境変化に対応し、生体内の恒常性を維持するための精緻なシステムを有しています。このようなシステムは、外部環境の変化を感知するためのセンシングシステムと、感知した情報に対応して細胞内の恒常性維持に必要な応答反応に関与するレスポンスレギュレーターシステムから構成されています。このようなシステムの中には、遷移金属イオンが関与しているシステムも多く存在しています。代表的な例として、酸素、一酸化炭素、一酸化窒素等の気体分子のような、単純タンパク質では応答不可能なシグナルに対する応答システムがあります。これらのシステムでは、分子中に遷移金属イオンを含む金属タンパク質がセンサー分子として機能することにより、遺伝子発現、走化性制御、セカンドメッセンジャー分子の合成・分解を介した代謝制御などの様々な生理機能制御に関与しています。また、遷移金属イオンそのものがシグナル分子として機能することにより、生理機能制御に必須な遷移金属イオンの細胞内濃度を適正に維持するために必要な分子マシナリー(金属イオン取込み・排出システム、細胞内金属輸送システム等)の発現制御、金属タンパク質の生合成制御など、様々な生理機能が制御されています。
我々は、構造生物学、遺伝子工学、分子生物学、および各種分光学的な実験手法を駆使することにより、シグナルセンシングやシグナル伝達に関与する新規な金属タンパク質の構造機能相関解明、および細胞内遷移金属イオンの恒常性維持の分子機構解明を目的として研究を進めています。
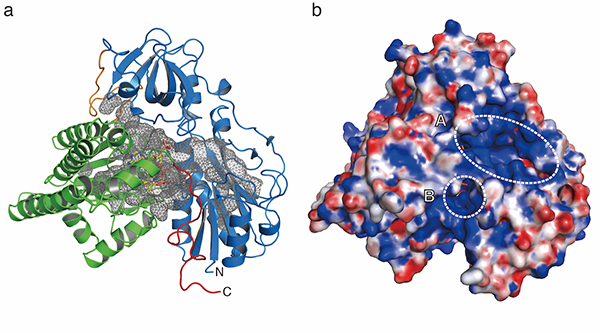 X-ray structure of HypX that catalyzes CO biosynthesis for the assembly of the active site in NiFe-hydrogenase. CoA, which is shown in a stick model, is bound in the cavity (gray mesh in (a)) . There are two open window (A and B in (b)) on the protein surface.
X-ray structure of HypX that catalyzes CO biosynthesis for the assembly of the active site in NiFe-hydrogenase. CoA, which is shown in a stick model, is bound in the cavity (gray mesh in (a)) . There are two open window (A and B in (b)) on the protein surface.