サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報
グループリーダー

生体分子動力学シミュレーション:タンパク質の折りたたみ、変性、凝集、アミロイド線維
分子動力学シミュレーション、拡張アンサンブル法、タンパク質
タンパク質は、多数のアミノ酸がペプチド結合によりつながったものです。アミノ酸の一次元配列情報をもとにタンパク質の立体構造を予測する問題をタンパク質の折りたたみ問題といいます。タンパク質は多くの自由エネルギー極小状態を持つので、通常のシミュレーション手法ではこれらの極小状態に引っかかってしまい、最安定状態になかなかたどり着けません。この問題を解決するためこれまでに有力な手法がいくつか提案されてきました。その代表例がレプリカ交換法です。我々はこの方法を改良したレプリカ置換法を開発しました。この方法では異なる温度を持つ系のコピー(レプリカと呼びます)を複数用意し、シミュレーションの途中で3つ以上のレプリカ間で温度を入れ替えます。この方法を使って様々なペプチドやタンパク質の折りたたみシミュレーションを行い、その折りたたみ過程を明らかにしてきました(図1)。
さらに医療への応用にも関心を持っています。タンパク質が間違って折りたたまれることによってひき起こされるミスフォールディング病という病気があります。アルツハイマー病やハンチントン病がその例です。これらの病気はタンパク質が間違って折りたたまれて、オリゴマーという球状の凝集体やアミロイドという針状の凝集体を作ってしまうことが原因です。しかし、これらの凝集体が形成されるしくみはまだよくわかっていません。我々はレプリカ置換分子動力学シミュレーションによりアルツハイマー病の原因となる凝集体の形成に重要なアミノ酸を特定しました。また、これらの凝集体は超音波や赤外線レーザーを使って破壊することができるのですが、その過程を非平衡分子動力学シミュレーションにより初めて解明しました(図2)。
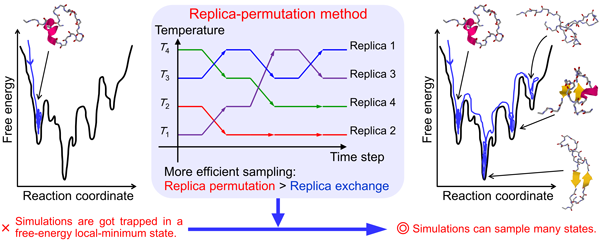
Fig. 1 Biomolecular systems have many free-energy local minima. Conventional molecular dynamics methods are trapped by these minima. We solved this problem by using the replica-permutation method.
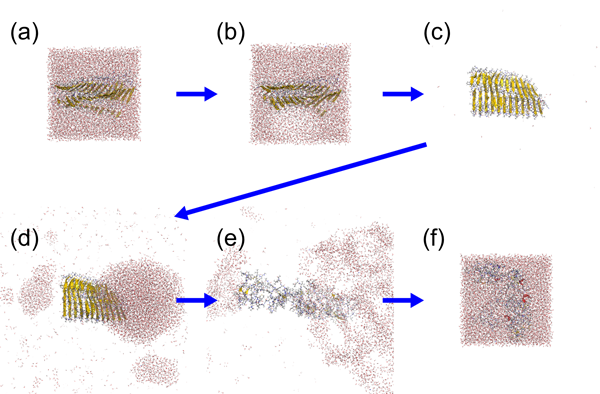
Fig.2 Disruption process of an amyloid fibril of Aβ peptides by ultrasonic wave. The amyloid fibril is disrupted when a bubble collapses.