サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報
お知らせ
2010/01/18
プレスリリース
[ 研究の背景]
細胞の中に生み出されたタンパク質は、一定の役割を終えると分解される必要があります。また働くことができ ない役に立たないタンパク質は、細胞にとって害をもたらす可能性があるので分解処分されなければなりません。 こうした不要なタンパク質は、分解のための目印としてユビキチンとよばれるタンパク質が多数くっつけられて分解されることが知られていました。しかし細胞の中の酵素が、どのようにして標的となる不要タンパク質に多数のユビキチンを効率的に結合させることができるのかはわかっていませんでした。
[ 研究の成果]
研究グループは、ユビキチンを標的に結合する酵素(E2)の3次元構造に取り組んだ結果、たくさんのE2 がユビキチンを介して、あたかも次々と肩車をしているかのようなかたちで集合していることを突き止めました(図参照)。このような集合体を形作ることにより、酵素は分解標的となるタンパク質上の様々な場所に手をとどかせて効率的に目印をつけることができると考えられます。
[ この研究の社会的意義]
細胞の中のタンパク質の分解がうまくいかないとガンやパーキンソン病などの重篤な疾患を引き起こされることが知られています。今回の発見は、こうした疾患の発症メカニズムの理解を促すことが期待されます。
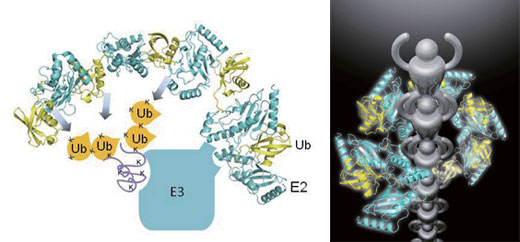
ユビキチン(Ub:黄色のタンパク質)と連結した酵素E2(水色のタンパク質)は肩車をくむように多 数集合してE3 という酵素の上に着地する。これによってE3が捕えている分解標的タンパク質(紫の紐)の上の様々な場所(Kと表示)に、分解の目印であるUb を効率良くくっつけることができる。
[用語解説]
ユビキチン:アミノ酸76 個からなる小さなタンパク質で、酵母からヒトにいたるまで真核細胞に普遍的に存在しています。2004 年のノーベル化学賞はユビキチンの仲介でタンパク質が分解される仕組みの発見に対して与えられています。
■論文情報
Structure(ストラクチャー),18 巻,137 ~ 147 ページ(1 月13 日発行)
論文タイトル:
Crystal structure of UbcH5b~ubiquitin intermediate: Insight into the formation of the self-assembled E2~Ub conjugates (UbcH5b ~ユビキチンの中間体の結晶構造:自己集合するUbcH5b ~ユビキチン連結体の形成についての考察)
著者:
Eri Sakata, Tadashi Satoh, Shunsuke Yamamoto, Yoshiki Yamaguchi, Maho Yagi-Utsumi, Eiji Kurimoto, Keiji Tanaka, Soichi Wakatsuki, Koichi Kato
■研究グループ
本研究は、自然科学研究機構岡崎統合バイオサイエンスセンター/ 分子科学研究所、名古屋市立大学大学院薬学研究科、高エネルギー加速器研究機構などとの共同研究により行われました。
■研究サポート
本研究は、文部科学省ターゲットタンパク研究プログラム、科学研究費補助金(新学術領域研究)「揺らぎが機能を決める生命分子の科学」等のサポートを受けて実施されました。
■本件に関するお問い合わせ先
加藤 晃一(かとう こういち)
自然科学研究機構岡崎統合バイオサイエンスセンター/ 分子科学研究所 生命環境研究領域・生命分子研究部門 教授
TEL: 0564-59-5225 FAX: 0564-59-5224
E-mail: kkatonmr@ims.ac.jp(送信時には@を半角にしてください)