サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報
お知らせ
2011/02/21
研究成果
[研究の背景]
細胞は脂質二重膜からなる細胞膜で内外を区切っているが、分子やイオンなどをやり取りすることで養分を得たり、老廃物を排出したりすることで生命活動を維持しています。このような物質のやり取りを行っているのが輸送体と呼ばれる一群の膜タンパク質です。その一種であるV-ATPase注1)は、生体内のエネルギー通貨と呼ばれるアデノシン三リン酸(ATP)の加水分解により、プロトンを細胞内の小胞内に輸送することで酸性環境を作り出します。骨代謝に関連する破骨細胞やガン細胞にも存在し、本酵素による酸性環境異常は骨粗鬆症やガン転移の原因の一つであるため、その特異的阻害剤は治療薬として期待されています。
類縁酵素であるバクテリア由来V-ATPaseはプロトン(H+)の代わりにナトリウムイオン(Na+)やリチウムイオン(Li+)を輸送する膜タンパク質です。9種類のサブユニット(A, B, C, D, E, F, G, I, K)から構成される超分子複合体膜タンパク質であり、全体の分子量は70万以上にもおよびます(図1)。これまでに、Kリングの原子レベルでの結晶構造解析がなされ、139番目のグルタミン酸を含むイオン結合部位のNa+, Li+イオン結合状態での構造が明らかにされています。このため真核生物由来のV-ATPaseのモデルタンパク質として様々な研究が進められています。V1ドメインがATPの加水分解により軸となるDサブユニットを回転させることで、細胞膜に埋まったV0ドメインのローターリング(K ring)が回転し、Iサブユニットとの境界で形成される半チャネルをイオンが一方向に透過します。これまでにNa+やLi+が結合したKリングのX線結晶構造が報告されていますが(T. Murata et al, Science, 2005, T. Murata et al,PNAS, 2008)、イオン脱着に伴う構造変化などを実験的に明らかにした例はありませんでした。
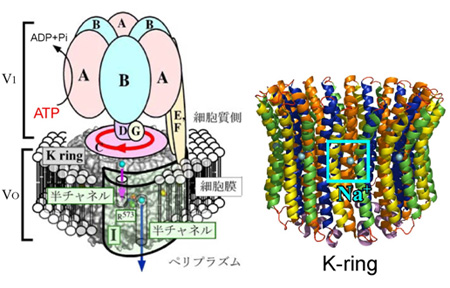
図1 (左)V-ATPaseのイオン輸送機構モデルと(右)K ringのイオン結合部位のX線結晶構造
[研究の成果]
今回、名古屋工業大学大学院工学研究科・神取秀樹教授および千葉大学大学院理学研究科・村田武士特任准教授との共同研究として、全反射型フーリエ変換赤外分光法(ATR-FTIR)注2)を用いた計測によりV-ATPaseの酵素活性を保った状態において、Na+およびLi+イオンの脱着に伴う構造変化を明らかにしました。ATR-FTIRは溶液に浸された状態での計測を可能とする赤外分光法の一種であり、分子の振動状態に応じた赤外吸収スペクトルを計測することができます。ATR用ダイヤモンドプリズム表面にV-ATPaseを吸着させ、Na+やLi+イオンを含む緩衝液を流すことで、これらのイオンが存在する状態としない状態との赤外吸収差スペクトルを計測することに成功しました(図2左)。その結果、V-ATPaseがNa+およびLi+イオンを結合するとK ringの139番目のグルタミン酸残基(E139)が脱プロトン化することで負に帯電し、イオン結合部位における電荷バランスを保つことで、疎水的な脂質二重膜を透過するエネルギー障壁を緩和することが明らかとなりました(図2)。また、E139と水素結合を形成している68番目のチロシン残基(Y68)がイオンの結合解離に重要な役割を果たしていることも示唆されました。さらに、イオン結合に伴ってK ringのタンパク質構造には大きな変化は観測されないこともわかりました。このことはV-ATPaseのイオン輸送においてK ringは大きな構造変化をせず、Iサブユニットとの間で形成される2カ所の半チャンネルにおいてイオンの結合解離を順次行うことで一方向性を獲得しているというこれまでのモデル(図1左)を支持する。阻害剤の一種である
測定前後において、SDS-ポリアクリルアミドゲル電気泳動(SDS-PAGE)によりタンパク質サブユニットの数と量、V-ATPaseのNa+イオン依存的なATPase活性を確認したところ、両者ともほとんど変化していないことが明らかとなりました。このことから赤外吸収差スペクトルはV-ATPaseが酵素活性を保った状態で計測されていることが保証されています。液中での計測を可能とするATR-FTIRはV-ATPaseのような超分子複合体タンパク質に対しても優しい計測法であることが確認されました。
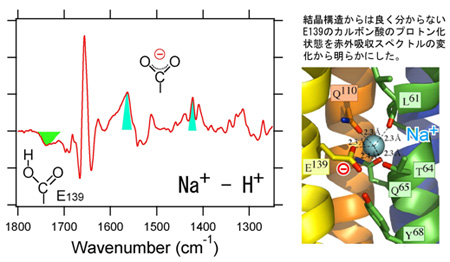
図2 (左)Na+結合解離に伴う赤外吸収差スペクトルと(右)K ringのイオン結合部位の結晶構造
[今後の展開及びこの研究の社会的意義]
今後、ATP存在下でV-ATPaseが機能している状態での赤外分光計測を行い、イオン輸送機構に重要な役割を果たすアミノ酸残基の構造変化を明らかにすることで、V1ドメインでのATP加水分解からVOドメインのKリングの回転に伴うNa+およびLi+の輸送機構のさらなる解明が期待されます。また、全反射型フーリエ変換赤外分光法は、V-ATPaseの機能発現に伴う構造変化を検出する新たな研究手法となりうることが実証されました。将来的には、様々な特異的阻害剤の候補化合物を効率的に見いだすため、赤外吸収差スペクトルを指標としたスクリーニング手法を構築することで、骨粗鬆症やガン転移を抑制する薬剤の開発に役立つ可能性が示されました。
用語解説
注1) V-ATPase:ATPの加水分解エネルギーを利用してプロトン(H+)やアルカリ金属イオン(Na+, Li+)を細胞内から膜小胞や細胞外に能動輸送する膜タンパク質。逆にプロトンの濃度勾配を利用してATPを合成するものはF-ATPaseと呼ばれており、ミトコンドリアでの電子伝達系での酸化的リン酸化の最後のATP合成を担うタンパク質である。V1, VOと同様にF1, FOドメインからなりF1の結晶構造を明らかにしたJohn Ernst Walker博士と回転触媒機構を提案したPaul Delos Boyer博士は共に1997年のノーベル化学賞を受賞している。また、1分子観察によりF1の回転を実証したのは日本の研究グループである(Noji, H., Yasuda, R., Yoshida, M., & Kinosita, K. Jr., Nature 386, 299-302, 1997)。
注2) 全反射型フーリエ変換赤外分光法(ATR-FTIR):赤外線は分子の振動を励起することで吸収されるため、横軸を波長、縦軸を吸光度とすると赤外吸収スペクトルが得られる。分子の振動状態は分子の構造や環境に敏感であるために赤外吸収スペクトルを計測することで、その分子がどのような構造をし、どのような環境に置かれているのかを知ることができる。フーリエ変換赤外分光法とは、赤外線の波長を、プリズムや回折格子で分けるのではなく、2つの赤外線を干渉させることで得られるインターフェログラムをフーリエ変換処理することで分ける手法を利用した赤外分光法のことである。試料を透過させることで減衰する赤外線の強度を計測する透過法では、試料に含まれる水の吸収が大きすぎるために液中での計測は困難である。一方、全反射型の光学系ではシリコンやダイヤモンドなどの屈折率の高い結晶の内部で赤外線を反射させ、全反射した界面で発生するエバネッセント光を利用する。赤外線は結晶内部を透過するために、結晶表面に存在する試料は液中に浸されていても計測することが可能である。このような利点があるため、近年、生体試料のイオンや基質の結合に伴う構造変化を解析する手法として注目を集めている(装置の詳細についてはアメリカ化学会の本論文のSupporting Informationを参照。ATR-FTIRの総説としては以下のものがある。Nyquist, R. M., Ataka, K., Heberle, J. Chembiochem, 5, 431-436, 2004, Rich, P. R., Iwaki, M. Mol. Biosyst. 3, 398-407, 2007)
■論文情報
掲載誌:Journal of the American Chemical Society(米国化学会誌JACS)
論文タイトル:Sodium or Lithium Ion Binding-Induced Structural Changes in the K-ring of V-ATPase from Enterococcus hirae Revealed by ATR-FTIR Spectroscopy
(全反射型フーリエ変換赤外分光法により明らかとなったEnterococcus hirae由来V型ATPaseのKリングにおけるナトリウムイオンおよびリチウムイオン結合に伴う構造変化)
著者:Yuji Furutani, Takeshi Murata, Hideki Kandori
掲載日:Publication Date (Web): February 14, 2011 (Communication), DOI: 10.1021/ja1116414
■研究グループ
神取 秀樹(かんどり ひでき)
名古屋工業大学大学院工学研究科、教授
古谷 祐詞(ふるたに ゆうじ)
自然科学研究機構・分子科学研究所、生命・錯体分子科学研究部門、生体分子情報研究部門、准教授
http://www.ims.ac.jp/research/assoc/furutani.html
村田 武士(むらた たけし)
千葉大学大学院理学研究科、特任准教授
■その他
本成果は、平成23年2月21日付、日刊工業新聞にて報道されました。