サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報
お知らせ
2011/02/17
研究成果
[研究の背景]
アルツハイマー病やプリオン病といった神経変性疾患の発症には、神経細胞膜上で分子集団(クラスター)を形成している糖脂質の存在が深く関わっていることが明らかにされつつあります。特に最近、神経系に豊富に存在する糖脂質GM1ガングリオシド(注1)は、アルツハイマー病に関わる、アミノ酸約40個が連結したアミロイドβ (Aβ)という物質の異常会合を引き起こすことが注目されています (図1)。
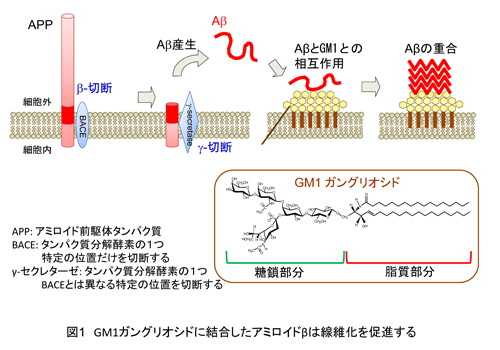
しかしながら、GM1ガングリオシドとの相互作用を契機として促進されるアミロイドβの何重にも重なるしくみに関する分子メカニズムは明らかとはなっていませんでした。その理由として、糖脂質は水溶液中において流動性を伴う分子量の大きな複合体を形成するために、GM1ガングリオシドとアミロイドβの複合体は一般的なX線構造解析などの構造生物学の方法論の適用が困難であったことが挙げられます。更に、GM1ガングリオシドと相互作用したアミロイドβはすみやかに線維化してしまい、両者の複合体を安定に捉えることが困難であることも詳細な構造解析を阻んできた要因となっています。そこで、こうした問題を克服し、物質の構造を高精度に調べることができる超高磁場核磁気共鳴(NMR)装置(注2)を用いてアミロイドβとGM1ガングリオシドの相互作用の構造的基盤を明らかにすることを試みました。
[研究の成果]
はじめに、GM1ガングリオシドとアミロイドβの複合体を安定に捉えるために様々なガングリオシドミセル(注3)を作製し、そのサイズを比較検討しました。その結果、GM1ガングリオシドミセル (140 kDa)(Da(ダルトン)はタンパク質の分子質量を示す単位) に比べて脂質部分が1本であるlyso-GM1ガングリオシド(lyso-GM1)は、小型のミセル (60 kDa) を形成し、かつ、アミロイドβの凝集を抑制することから、詳細なNMR解析のモデル系として有用であることが明らかとなりました。さらに、分解能の低下につながる信号の広幅化(信号がシャープでなくなること)を改善するために、13C、15Nに加えて2Hを用いて安定同位体三重標識を施したアミロイドβ(1-40)を調製し、分子科学研究所が有する世界トップレベルの分解能の920 MHz超高磁場NMR装置を利用した計測を行いました。それにより、巨大なGM1ガングリオシドとアミロイドβの複合体の詳細な構造がわかる高分解能NMR計測に初めて成功しました。
NMR解析の結果から、40個のアミノ酸が結合したアミロイドβ(1-40)は中央部分に2つのらせん状の構造(αへリックス構造)を形成してGM1ガングリオシドミセルに結合しており、他の領域は特定の二次構造を形成していないことが判明しました(図2)。また、飽和移動実験(注4)の結果から、アミロイドβ(1-40)はGM1ガングリオシドクラスターの親水性と疎水性の境界面に横たわるかたちで結合しており、2つのα-ヘリックスとC末端(39番目および40番目のアミノ酸残基)はミセル内部に埋もれ、それ以外の領域はミセル外部に露出していることが明らかとなりました [1] (図2)。
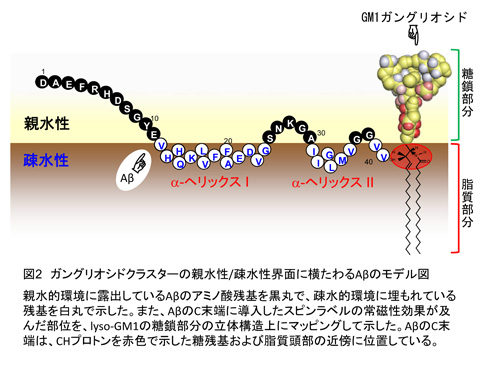
次に、アミロイドβ分子を取り巻く環境に着目し、アミロイドβが結合したガングリオシドクラスター側の高次構造情報を得ることを試みました。まず、NMRによって得られた距離情報を制限項として分子動力学計算を行うことにより、lyso-GM1の糖鎖部分のコンフォメーション(注5)を決定しました。さらに、GM1ガングリオシドとアミロイドβの分子間のより広範囲に及ぶ距離情報を抽出するため、アミロイドβの特定部位のアミノ酸を他のアミノ酸に置き換え、特殊な化学試薬を反応させることによりスピンラベル化(注6)されたアミロイドβを作製し、GM1ガングリオシドクラスター上のアミロイドβ結合部位を同定しました。その結果、アミロイドβの結合および上記トポロジー(注7)の形成には、GM1ガングリオシドクラスターの内側にあたる糖残基および脂質の頭部部分が重要であることが明らかとなりました [2] (図2)。
次に、GM1ガングリオシドクラスターの親水/疎水界面に結合した状態のアミロイドβが、アミロイド線維を形成するに至る構造変化の過程を解明することを試みました。アミロイドβとGM1ガングリオシドミセルの量比を系統的に変化させてNMR計測および真空紫外円二色性スペクトル(注8)を計測した結果、両者の量比に依存したスペクトルの変化がみとめられました。興味深いことに、AβがGM1ミセル上に密に存在する条件下においては、C末端領域に由来するNMRピークが複数観測され、アミロイド線維などのβシート構造(注9)に特異的に結合して発色する蛍光色素チオフラビンTとの結合性を示しました。これらの結果から、アミロイドβのC末端がGM1ガングリオシドクラスター上におけるアミロイドβ分子間の相互作用に起因していることが示唆されました [3]。
以上の結果より、ガングリオシドクラスターはアミロイドβ分子の構造変化を誘起するとともにその特徴的な空間配置を規定するような環境場を形成していることが明らかとなりました。これによりアミロイドβのC末端領域における特異的な分子間相互作用が促され、アミロイドβが積み重なる重合体形成に至るものと考察されます。
[今後の展開]
アミロイドβの重合開始を担うGM1ガングリオシドとアミロイドβとの複合体の高次構造を解明することは、アルツハイマー病をターゲットとする創薬研究の基礎を築くとともに、糖脂質クラスターとタンパク質の相互作用の一般的な理解を促します。今後は、今回同定した構造変化の先にあると考えられる現象、すなわち、特徴的なトポロジーにより規定されるアミロイドβ-アミロイドβ分子間の過渡的な相互作用を詳細に捉え、アミロイドβの重合開始のメカニズムを段階的に明らかにしていきたいと考えています。
また、アミロイドβとGM1ガングリオシドの相互作用系にみられるように、細胞表層におけるタンパク質の糖鎖認識は、糖脂質分子がクラスターを形成してダイナミックな「相互作用の場」を提供することが要求されます。このような揺らぎを伴う超分子系を解析対象とすることは実験・理論のいずれのアプローチにおいても困難を伴います。中でも複雑な分岐構造と著しい不均一性を示す糖鎖は取扱いが厄介であり、糖鎖の分子科学的研究はタンパク質や核酸に比べて著しく立ち遅れてきました。したがって、こうした複雑なシステムに対しても構造生物学的な研究手法を開拓し、糖鎖-タンパク質相互作用さらには糖鎖-糖鎖相互作用の構造基盤を探求していきたいと考えています。
用語解説
注1)ガングリオシド:シアル酸を含有するスフィンゴ糖脂質の総称。主として脳組織・神経系組織に存在している。
注2) 核磁気共鳴(NMR:Nuclear Magnetic Resonance):磁場中に置かれた磁気モーメントをもつ原子核が、特定の周波数の電磁波を吸収して、エネルギーの低いスピン状態からエネルギーの高いスピン状態に移り変わること。医療用の画像診断装置として用いられているMRI(Magnetic Resonance Imaging)と原理的にはおなじである。
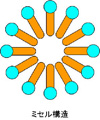 注3) ミセル:親水性の部分(GM1では糖部分)と、疎水性の部分(GM1では脂質部分)の両方を持つ両親媒性分子が水中でとる構造体の一つ。右図のように、親水性の部分(水色の丸)が外側に露出し、疎水性の部分(オレンジ色)が内側になる構造。
注3) ミセル:親水性の部分(GM1では糖部分)と、疎水性の部分(GM1では脂質部分)の両方を持つ両親媒性分子が水中でとる構造体の一つ。右図のように、親水性の部分(水色の丸)が外側に露出し、疎水性の部分(オレンジ色)が内側になる構造。
注4) 飽和移動実験:ある特定のシグナルにパルスを照射して飽和した際に、磁化移動もしくは化学交換を通じて他のピークの強度が減弱することを利用するNMRの測定手法。強度の減弱度合いから、構造情報を抽出することができる。
注5)コンフォメーション:立体配座ともいう。単結合についての回転や孤立電子対を持つ原子についての立体反転によって相互に変換可能な空間的な原子の配置のこと。
注6) スピンラベル化:電子スピン共鳴を観測したり,NMRに電子スピンが及ぼす効果を調べるために,MTSL([1-oxy-2,2,5,5-tetramethyl-D-pyrroline-3-methyl]-methanethiosulfonate)などの不対電子を有する化合物(スピンラベル剤)を,研究対象とする分子(タンパク質や脂質など)にプローブとして導入すること。生体分子の立体構造や運動性に関する情報を得るために用いられる。
注7) トポロジー:本来は位相幾何学を意味するが、ここでは親水性/疎水性境界面に対するタンパク質(Aβ)の方向性を含めた空間的配置を指す。
注8) 真空紫外円二色性(CD)スペクトル:真空紫外域において観測されたCDスペクトルは、物質の立体構造を反映するため、タンパク質の二次構造解析などに利用される。
注9) βシート構造:αへリックス構造とともに主要なタンパク質の立体構造の基本パターン。αへリックスは1本のポリペプチド主鎖が規則正しくらせん状に巻いた構造。βシートはポリペプチド鎖が「分子間」で水素結合することによって形成される平面構造。
■論文情報
[1]Glycoconjugate Journal, 26, 999-1006 (2009)
Up-and-down topological mode of amyloid β-peptide lying on hydrophilic/hydrophobic interface of ganglioside clusters
(GM1クラスターに結合したアミロイドβのトポロジーのNMR解析)
Maho Utsumi, Yoshiki Yamaguchi, Hiroaki Sasakawa, Naoki Yamamoto, Katsuhiko Yanagisawa and Koichi Kato
[2] FEBS Letters, 584, 831-836 (2010)
NMR characterization of the interaction between lyso-GM1 aqueous micelles and amyloid β
(NMR法によるlyso-GM1ミセルとアミロイドβの相互作用解析)
Maho Yagi-Utsumi, Tomoshi Kameda, Yoshiki Yamaguchi and Koichi Kato
[3]International Journal of Alzheimer’s Disease, ID 925073 (2011)
Spectroscopic characterization of intermolecular interaction of amyloid β promoted on GM1 micelles
(分光学的手法によるGM1ミセル上で誘起されるアミロイドβの分子間相互作用の同定)
Maho Yagi-Utsumi, Koichi Matsuo, Katsuhiko Yanagisawa, Kunihiko Gekko and Koichi Kato
■研究グループ
加藤 晃一(かとう こういち)
自然科学研究機構・分子科学研究所・岡崎統合バイオサイエンスセンター、生命環境研究領域、教授
http://www.ims.ac.jp/research/prof/katok.html
矢木真穂(やぎ まほ)
自然科学研究機構・分子科学研究所・岡崎統合バイオサイエンスセンター、博士研究員