サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報
お知らせ
2011/12/19
研究成果
[研究の背景]
寒くなり、風邪の季節となりました。のどが痛い、熱がある、鼻水が止まらない。風邪の症状はどれも辛いものです。最近では市販薬も増え、自分で風邪薬を選んでいる人も多いと思います。さて、この風邪薬ですが、実際に手にとって成分を見てみますと、様々な化合物の名前を見つけることができます。アセチルサリチル酸(アスピリン)、塩化リゾチーム、フマル酸クレマスチンなどなど……。それぞれ、発熱、のどの痛み、鼻づまりに効く成分と言われていますが、ここでよく考えてみましょう。人の大きさ(=モルの世界:1023個以上の分子でできている世界)に対して、これら分子の世界はあまりに小さいです。実のところ、このような薬が体の中でどのように作用しているのか、ほんの数十年前までは全く分からなかったのです。しかし、医学、薬学、生化学などの発展により、薬の分子がどのようにして病気の原因となるバクテリアやウイルスを退治しているのかが、明らかになってきました。
今回は、平田グループが得意分野とする統計力学に基づく「知的創薬」に関する研究の紹介を行います。「知的創薬」そのものがあまり耳慣れない概念ですので、まず「知的創薬」のアウトラインを、以下①~③で説明します。
①生体機能と分子認識
我々生物の細胞内では生命を維持したり、子孫に継承したりするために様々な生体分子(蛋白質やDNAなど)が活躍しています。例えば、赤血球の中にあるヘモグロビンという蛋白質は肺の中で酸素分子を結合し、それを末端の組織に運ぶ「運送屋」の役割を果たしています。それで、もし、何らかの障害でヘモグロビンが働かなくなると人間は死んでしまいます。例えば、人間が一酸化炭素を吸収するとヘモグロビンはそれを優先的に結合するため、酸素を結合できなくなってしまいます。それが、いわゆる一酸化炭素中毒です。
この例の他にも、蛋白分子は糖や脂肪やアルコールなどを分解したり(酵素)、細胞内外の水分を調節したり(水チャネル)などなど、生体内で様々な役割を果たしていますが、生物が生命を維持し継承するために生体分子が果たす役割を生体分子の「機能」と呼んでいます。そして、生体分子がその機能を営むためには、その対象となる分子(「リガンド」や「基質」などと呼ぶ)を自分自身のある特定の場所(活性部位、反応ポケット)に選択的に結合する必要があります(ヘモグロビンの例で言えば、「へム」と呼ばれる場所が活性部位にあたり、酸素分子がリガンドにあたる)。
このように、生体分子があるリガンドを選択的に結合する過程をより一般的に「分子認識」と呼んでいます。したがって、分子認識は生命現象の最も本質的な素過程と言うことができます。この分子認識過程が何らかの原因で阻害されると人間は病気になったり、ひどい場合は死んでしまうことになります。
②お薬はどのように効くか?
バクテリアやウイルスも生物の一種ですので、彼らが生きていくために、やはり、たくさんの蛋白質やDNAが機能を果たしています。そして、その素過程として、常に、蛋白質やDNAの分子認識過程が働いています。したがって、もし、バクテリアやウイルスの生存や増殖に不可欠な蛋白質やDNAの分子認識過程を阻害することができれば、これらのばい菌を死滅させ、病気を治すことができます。病気を治すために使う薬剤分子の多くは、バクテリアやウイルスの蛋白質やDNAに優先的に結合して、その機能を阻害する役割を果たしているのです。
③分子認識の強さは何できまるか?
薬剤分子がその役割を果たすためには、バクテリアやウイルスの蛋白質やDNAに優先的に結合する必要があると言いましたが、そのような結合の優先順位を決める因子とは何でしょうか?それを熱力学の言葉で“自由エネルギー”と呼びます。平たく言えば、分子のある環境における「居心地の良さ」の尺度だと言えばそれほど間違っていません。自由エネルギーが低いほど、「居心地が良い」ということになります。リガンドや薬剤分子の場合、蛋白質内の活性部位に結合している場合の自由エネルギーの方が蛋白質の外(バルク)の環境に居るより低ければ、それらの分子は蛋白質に「結合」、あるいは「認識」されることになります。そして、その差が大きければ大きいほど、より優先的に認識されることになります。したがって、分子認識によって自由エネルギーができるだけ低くなる化合物(分子)を探索することが、創薬の重要なステップのひとつになります。
それでは、結合の自由エネルギーを決める因子は何でしょうか? まず、誰でも思いつくのは、蛋白質の活性部位の幾何形状と薬剤分子のそれとの相性です(鍵と鍵穴)。次に思いつくのは活性部位内の電荷分布と薬剤分子のそれとの相性です(もし、活性部位の電場が正であり、薬剤分子の電荷も正であれば、薬剤分子は静電反撥ではじき出されてしまう)。
しかし、それだけでは結合の自由エネルギーは決まりません。さらに大きな要因は蛋白質やDNAが存在する環境、すなわち、水溶液にあります。蛋白質は水溶液中にあるため、多くの場合その活性部位にも水分子が結合しています。リガンドや薬剤分子が活性部位に結合するためには、その水分子の全部または一部が排除される必要があります。一方、薬剤分子の方も蛋白質に結合する前は水溶液の環境に居るので、その周りには水分子の「衣」をまとっています(このような状態を「水和」と呼びます)。
したがって、薬剤分子の方も蛋白質と結合するためには、その水分子の全部または一部を取り除く(脱水和)必要があるのです。このように、結合の自由エネルギーには蛋白質と薬剤分子の幾何形状や電荷分布だけではなく、水和や脱水和の自由エネルギー変化が大きな要素として含まれています。
しかし、従来、「知的創薬」と称して企業や大学で行なわれてきた方法の大部分はこの水和や脱水和の自由エネルギーを無視してきました。この欄で紹介するトピックスは、この問題を克服して、水和や脱水和の自由エネルギーも含めた知的創薬の新しい方法を提案したものです。
[研究の成果]
平田グループでは、液体の統計力学理論のひとつである3D-RISM理論を開発し、それを用いて、分子認識過程を含む生体分子機能に関する研究を行ってきました(2007年度アクティビティ紹介参照:http://www.ims.ac.jp/news/2007/12/post-154.html)。今回は、この3D-RISM理論に基づいて、創薬への応用を直接目指した「タンパク質の分子認識過程の研究」を紹介します。対象としたのは、ホスホリパーゼA2(Phospholipase A2)と呼ばれるタンパク質です。このタンパク質は、発熱や痛みのもとになるアラキドン酸を合成することで知られています。また近年、非ステロイド性の薬として有名なアセチルサリチル酸(アスピリン)も結合することが実験によって明らかにされました(図1)。新たな薬の開発にもつながるため、創薬分野でモデルタンパク質の一つとされています。
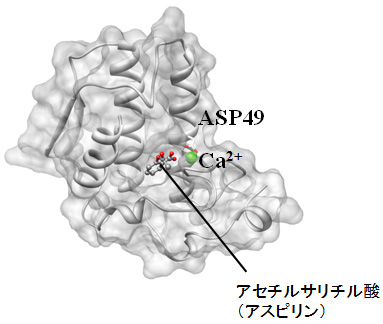
図1.X線構造解析によってとられた、ホスホリパーゼA2にアセチルサリチル酸(アスピリン)が結合する様子。結合ポケットは、カルシウムイオンCa2+(図中、緑色の球)とアスパラギン酸(ASP49)等によって形成されると考えられている。
3D-RISM理論を用いてこのようなタンパク質-リガンド分子系を解くと、タンパク質の内外におけるリガンド分子の分布関数を求めることができます(図2)。
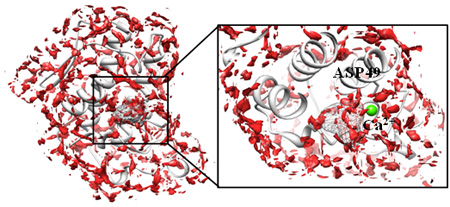
図2.ホスホリパーゼA2に対する3D-RISM理論を用いて計算したアセチルサリチル酸の分布(赤色で表示)。X線構造においてアセチルサリチル酸が存在していた箇所(図中、網目で表示されている箇所)にも分布していることが分かる。
分布関数は、その位置にどのくらいの確率でリガンド分子が存在するかの指標を表す関数です(この関数の逆数の対数をとると、それは水和の「自由エネルギー」に対応します)。従って、分布関数が大きい値を取る箇所(図中、赤で示されている箇所)は、その場所にリガンドが結合しやすいことを意味します。この分布関数を解析すれば、自動的にリガンド分子がどこにどのように結合するのかが分かります。
今回は、そのような解析のためのスコア関数を定義し、それに基づいてリガンド分子であるアスピリンの位置および配向を特定しました。解析結果を図3に示します。図は、定義したスコア関数におけるトップスコアであり、3D-RISM理論から予測した構造が実験で得られた構造とほぼ一致していることが分かります。
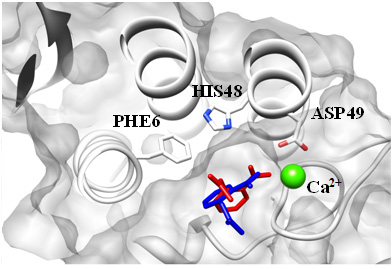
図3. 3D-RISM理論から予測された構造(赤)と実験で得られた構造(青)の比較。両者はほぼ一致していることが分かる。
スコア関数を用いた解析は、一般的な創薬研究でも同じように行われていますが、その多くは物理化学的な根拠を持っていません。言い換えると、多くの場合、鍵と鍵穴のように幾何学的な議論しかしていません。私たちの研究の強みは、分布関数という物理化学的に重要な意味を持つ量を基にしていることです。今回のような解析が確立すれば、より確かな創薬研究が可能になると考えています。
■論文情報
雑誌:Journal of Chemical Theory and Computation (JCTC) 2011, 7(11), 3803–3815(米国化学会の発行する理論系専門学術雑誌)DOI: 10.1021/ct200358h
題目:A New Approach for Investigating the Molecular Recognition of Protein: Toward Structure-Based Drug Design Based on the 3D-RISM Theory(タンパク質の分子認識を研究するための新しいアプローチ:3D-RISM理論を基礎とした分子構造に基づく医薬品設計)
著者:Yasuomi Kiyota, Norio Yoshida, and Fumio Hirata
掲載日:2011年9月15日
■研究グループ
平田 文男(ひらた ふみお)
自然科学研究機構 分子科学研究所 理論・計算分子科学研究領域・教授
平田Gホームページ http://daisy.ims.ac.jp