サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報
お知らせ
2012/08/07
プレスリリース
自然科学研究機構分子科学研究所(岡崎統合バイオサイエンスセンター)の青野重利教授および独立行政法人理化学研究所播磨研究所放射光科学総合研究センターの城宜嗣主任研究員の研究グループは、生命維持に不可欠な金属元素である鉄を含む化合物「ヘム (*1)」の細胞内濃度を調節するタンパク質を特定し、ヘム濃度を一定に保つための“しくみ”を世界で初めて原子レベルで明らかにしました。
私達の細胞内では、鉄を含む化合物であるヘムがタンパク質と結合することにより、酸素の運搬貯蔵などの多様な生理機能を発揮しています。その一方で、タンパク質に結合していない遊離のヘムは、活性酸素 (*2) を発生させるなどの働きがあり、細胞にとっては猛毒となります。遊離のヘムによる毒性を抑えるために、多くの生物が細胞内のヘム濃度を厳密に制御するシステムを持っています。しかし、細胞内ヘム濃度を一定に保つためのしくみは、全ての生物で未解明でした。
本研究グループは、生化学的な実験やX線結晶構造解析 (*3) により、有毒な遊離のヘムを感知して細胞外へ排出するためのスイッチとして働くタンパク質を特定し、細胞内ヘム濃度を一定に保つシステムの詳細を明らかにしました。
本研究では、チーズなどの発酵乳製品製造で用いられる乳酸菌をモデル生物に選びました。乳酸菌は、ヘムを菌体内で合成することはできませんが、外からヘムを取り込むことでヘムを用いた生理機能を発揮することが知られていました。本研究グループは、この乳酸菌の細胞内には遊離のヘムを感知するヘムセンサータンパク質が存在し、このタンパク質がヘム濃度を一定に保つシステムのスイッチとして働くことを明らかにしました(図1)。つまり、ヘムを取り込んでいない時は、ヘムを細胞外へ排出するための遺伝子 (ヘム排出遺伝子)と結合して働かないようにしています。一方、ヘム濃度が高くセンサータンパク質がヘムを取り込むようになると、このタンパク質は遺伝子からはずれて、ヘム排出の働きがオンになります。
このセンサータンパク質がスイッチとして働く仕組みについて更に詳しく調べるために、ヘムを取り込んだ状態・ヘムを含まない状態・ヘムを含まずに遺伝子と結合している状態のそれぞれについて、世界最先端の大型放射光施設であるSPring-8 (*4)を用いてX線結晶構造解析を行い、タンパク質を構成する1つ1つの原子の位置(立体構造)を決定しました。その結果、このセンサータンパク質がヘムを取り込む時には、アミノ酸の一種であるヒスチジン分子2個(図2のHis72とHis149)でヘムをつなぎ止めていることがわかりました。ヘムを含まない時は、片方のヒスチジン(His72) の近くにヒモ状に原子が並んだ構造がありますが、ヘムが取り込まれるとその部分がラセン状の構造に変化することが分かりました(図2の橙色部分)。この構造変化に伴って遺伝子と相互作用する領域が持ち上がり(図1の緑色部分)、このタンパク質は遺伝子に結合できなくなります。これらの結果は、遊離のヘムをセンサータンパク質が感知してヘム排出システムのスイッチがオンとなるしくみを、分子の構造変化という原子1つ1つのミクロなスケールで明らかにしたものといえます。
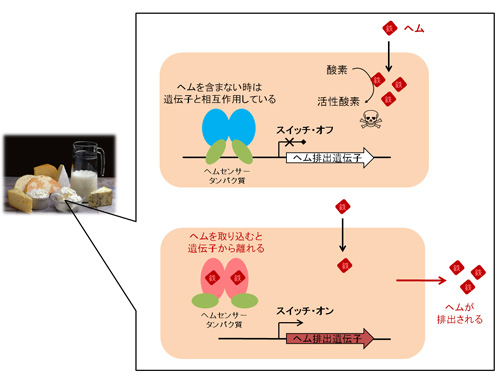
図1. 乳酸菌における細胞内ヘム濃度の制御メカニズム
クリーム色の四角は乳酸菌の細胞を表している。
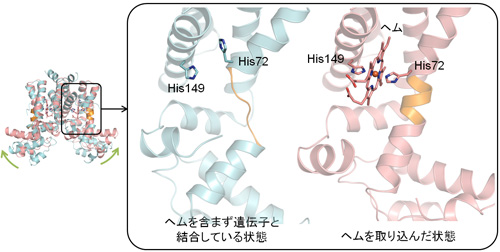
図2. ヘム結合の有無による立体構造の違い
左の図は、各状態の全体構造を重ねたもの。
本研究は、乳酸菌のヘム排出システムを研究対象としていますが、類似のシステムはある種の病原性細菌にも存在します。本研究成果は、遊離ヘムによる細胞毒性を回避できなくして病原性細菌の増殖を阻害する、新しいタイプの抗生物質の開発に貢献する可能性があります。今回、X線結晶構造解析により、タンパク質を構成する原子の位置を詳細に明らかにできたので、作用メカニズムを厳密に制御できる医薬品の開発が可能となり、副作用が少なく効果の高い薬剤の開発に貢献できます。
用語解説
1) ヘム
ポルフィリンと呼ばれる環状平面分子の中心に鉄原子をもつ化合物。ポルフィリン環の修飾の種類や位置によっていくつかの種類に分類される。ヘムを分子中に取り込んではじめてその機能が発揮されるタンパク質をヘムタンパク質と呼び、通常、赤色を呈する。酸素運搬体であるヘモグロビン、電子伝達に関与するシトクロム類、酵素活性をもつペルオキシダーゼなどがヘムタンパク質の代表例。
2) 活性酸素
大気中に含まれる酸素分子が化学的に反応性の高い状態に変化した化学種の総称。OH・(ヒドロキシラジカル)、O2・-(スーパーオキサイドアニオンラジカル)、H2O2 (過酸化水素)などがある。DNA、脂質、タンパク質などの生体分子に酸化ダメージを与え、本来の生理機能を失わせる作用がある。
3) X線結晶構造解析
波長の短い光の一種であるX線を、物質が規則正しく並んだ結晶に照射し、回折されたX線の強度を詳しく解析することにより、結晶を構成する分子の構造を決定する方法。この方法により、多くの生体分子の立体構造が決定されている。
4) 大型放射光施設SPring-8
兵庫県の播磨科学公園都市にある世界最高の放射光を生み出す理化学研究所の施設。SPring-8の名前はSuper Photon ring-8 GeV(80億電子ボルト)に由来。放射光とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げた時に発生する強力な電磁波のこと。SPring-8では、この放射光を用いてナノテクノロジー・バイオテクノロジー・産業利用まで幅広い研究が行われている。
掲載誌:Journal of Biological Chemistry (J. Biol. Chem.)
(アメリカ生化学および分子生物学会の発行する生物科学系学術雑誌)
論文タイトル:Structural basis for the transcriptional regulation of heme homeostasis in Lactococcus lactis
(乳酸菌におけるヘムの恒常性維持に関わる遺伝子転写調節の構造的機序)
著者:Hitomi Sawai, Masaru Yamanaka, Hiroshi Sugimoto, Yoshitsugu Shiro, Shigetoshi Aono
掲載日:2012年7月13日付オンライン版
DOI: 10.1074/jbc.M112.370916
本研究は、自然科学研究機構分子科学研究所(岡崎統合バイオサイエンスセンター)の青野重利教授、澤井仁美特任助教、山中優博士研究員と、独立行政法人理化学研究所播磨研究所放射光科学総合研究センターの城宜嗣主任研究員、杉本宏専任研究員との共同研究により行われました。
本研究は、文部科学省科学研究費補助金の基盤研究(B)(課題番号23350084)、若手スタート支援(課題番号22870043)の一環として行われました。さらに、野田産業科学研究所研究助成、公益信託山村富美記念女性自然科学者研究助成基金、資生堂女性研究者サイエンスグラントによる支援を受けて進められました。
青野 重利(あおの しげとし)
分子科学研究所・岡崎統合バイオサイエンスセンター・戦略的方法論研究領域・ 生物無機化学部門・教授
TEL/FAX: 0564-59-5576
E-mail:aono_at_ims.ac.jp
自然科学研究機構・分子科学研究所・広報室
報道担当
TEL/FAX 0564-55-7262
E-mail: kouhou_at_ims.ac.jp