サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報
お知らせ
2015/02/03
プレスリリース
大阪大学蛋白質研究所高木淳一教授のグループおよび分子科学研究所(岡崎統合バイオサイエンスセンター)加藤晃一教授のグループらは、アルツハイマー病の原因物質を「掃除」するタンパク質の立体構造を解明しました。
アルツハイマー病などの神経変性疾患の多くは、脳内で生じる「アミロイド」と呼ばれる繊維状凝集体が神経細胞を死滅させ、脳の機能にダメージを与えることでおこると考えられています。この凝集体の蓄積は長い年月をかけて起こるため、いったん生じるとそれを除去することは難しく、最初からこの凝集体が蓄積しないようにする治療法が必要と考えられています。
阪大高木淳一教授の研究グループは以前に、sorLA(ソーラ)という脳内の膜タンパク質が、できたばかりのAβペプチド(アミロイドを形成するものの一種)を捕まえて分解系に送ることによりその蓄積を防ぐことを報告していましたが、今回あらたに、sorLAがAβペプチドを「捕まえている」ところを原子レベルで立体構造解析することに成功しました。この成果は、我々の体内にもともと存在するアルツハイマー病に対する防御因子の作用メカニズムを明らかにしたものとして注目されます。本成果は英科学誌「Nature Structural & Molecular Biology」に2月2日付け(英国標準時間16:00pm、日本時間3日1:00am)で掲載されます。
我々の脳内では加齢にともなって様々な「神経毒性」をもつ物質が蓄積し、その毒性によって死滅する神経細胞が多くなると脳の機能が減退し、認知症などの症状がでることになります。アルツハイマー病ではとくに、アミロイドβ(Aβ)と呼ばれるペプチドが長い年月をかけて凝集して脳内に特徴的な「老人斑」と呼ばれる構造体をつくり、その毒性によって神経細胞が死滅すると考えられています。Aβは正常なタンパク質が切断されて生じるいわば「ゴミ」のようなもので、だれでも持っているものですが、なにかの理由でこの切断が多くなったり、切断されたAβが凝集しやすい性質をもっているとアルツハイマー病を発症しやすいことが知られています。アルツハイマー病の予防や治療には、この切断を制御したり、生じたAβが凝集しないようにすることが有効だと考えられ、世界中でそのような方法の開発にしのぎが削られていますが、いまだにそのような方法や薬は見つかっていません。
sorLAは神経ニューロンに多く存在する膜タンパク質で、アルツハイマー病の患者さんの脳においてsorLAの量が健常人より少ないなど、このタンパク質とアルツハイマー病発症のリスクに関連があることが数年前から示唆されていました。蛋白質研究所の高木淳一教授らは昨年、このsorLAタンパク質がAβを結合する性質があることを見つけ、さらにマウスを使った研究から、sorLAが脳内で生じるAβペプチドを分解系へ運ぶ「掃除屋」のような役割を果たしていることを報告しました。そこで、なぜAβペプチドのような危険なペプチドだけを捕まえることができるのかを明らかにするために、X線結晶構造解析および核磁気共鳴法(NMR)という方法を用いて、sorLAの細胞外領域の原子分解能の構造を、Aβペプチドを捕まえた状態と捕まえる前の状態で決定することに成功しました。
今回あきらかになったのはsorLAの細胞外領域のなかでもVps10pドメインと呼ばれる部分の構造で、それは図1左のように、10枚の羽根をもつプロペラーのような形をしており、中央部には大きな穴(トンネル)が空いていました。そしてAβペプチドはこのトンネルの内側にへばりつくように結合していることがわかりました。その結合は「βシート拡張」と呼ばれる、生体内でアミロイドを形成するペプチドに特有のやり方で達成されていました。 生体内で不溶性の沈着物を形成するのがAβなどの「アミロイドペプチド」と総称されるペプチドの性質ですが、その実体は「クロスβ構造」と呼ばれる長い不溶性の線維が束になったものです。sorLAとAβペプチドの結合部位で見られた「βシート拡張」は、このクロスβ構造の先端部分と良く似ている事がわかりました。この立体構造から、sorLAがなぜアミロイド形成をしやすいペプチドを捕まえられるのかがわかりました。我々の脳のなかではAβのような危険なペプチドが毎日少しずつ作られています。それらが「クロスβ構造」をつくってどこまでも伸びる(つまり脳内で毒性のあるアミロイドに変わる)のを、sorLAは狭いトンネルに閉じ込めることで未然に防いでいるのではないか、と考えられます。
アルツハイマー病の予防と治療のためには脳内Aβレベルを下げることが有効であると考えられますが、現時点で有望な薬はまだ開発されていません。今回の結果は、sorLAがAβペプチドを処理するメカニズムを明らかにしました。さらにこの構造からは、sorLAがAβ以外の「危険な」ペプチドも捕まえて分解経路にまで運んでいく能力を持つことが示唆されました。脳内のsorLAの機能を賦活化することで、アルツハイマー病だけでなく、様々な神経変性疾患の発症リスクを低減することができる可能性があり、今後の研究の進展が期待されます。
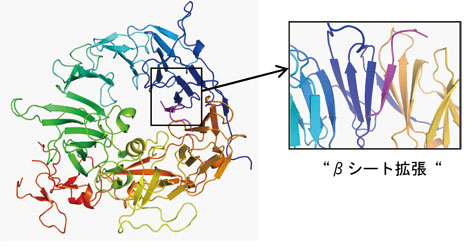
図1 sorLA Vps10pドメイン(虹色で示す)とAβ(濃いピンク部分)の複合体構造
掲載誌:Nature Structural & Molecular Biology
論文タイトル: Structural basis for amyloidogenic peptide recognithion by sorLA
著者:Yu Kitago, Masamichi Nagae, Zenzaburo Nakata, Maho Yagi-Utsumi, Shizuka Takagi-Niidome, Emiko Mihara, Terukazu Nogi, Koichi Kato & Junichi Takagi
DOI番号:10.1038/nsmb.2954
本研究は、自然科学研究機構岡崎統合バイオサイエンスセンター / 分子科学研究所(加藤晃一教授)、大阪大学蛋白質研究所高木淳一教授のグループらとの共同研究により行われました。
本研究は、文部科学省科学研究費補助金新学術領域研究「生命分子システムにおける動的秩序形成と高次機能発現」、文部科学省ナノテクノロジープラットフォーム事業(分子・物質合成)等のサポートを受けて実施されました。
加藤晃一(かとうこういち)
自然科学研究機構岡崎統合バイオサイエンスセンター/分子科学研究所、教授
TEL: 0564-59-5225 FAX: 0564-59-5224
E-mail:kkatonmr_at_ims.ac.jp
自然科学研究機構・分子科学研究所・広報室
TEL/FAX 0564-55-7262
E-mail: kouhou_at_ims.ac.jp