サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報
お知らせ
2015/10/07
プレスリリース
|
自然科学研究機構分子科学研究所生命・錯体分子科学研究領域の塚本寿夫助教と古谷祐詞准教授は、生理学研究所の久保義弘教授、大阪市立大学の寺北明久教授・小柳光正准教授、米国Oregon Health & Science UniversityのDavid Farrens准教授との共同研究により、ヒトなど哺乳類において環境光による体内時計のリセットに関わる光受容分子メラノプシンが、自発的に光を受容する能力を失う特徴を持つことを明らかにしました。今回明らかになったメラノプシンの特性は、体内時計の光リセットなど「視覚ではない光受容」が、一つの分子の性質によってどのように制御されているのかについて知見を与えると共に、メラノプシンの分子特性を利用した疾患治療や研究手法開発への貢献も期待されます。
本成果は、2015年9月28日付でAmerican Society for Biochemistry and Molecular Biology発行のJournal of Biological Chemistry誌オンライン版に発表されました。 |
ヒト、マウス、ハエなどの動物は光情報を様々な生理機能に利用しており、特定の事物の色・かたち・動きを高い時空間分解能で感知する視覚のみならず、周辺の光環境に応じて体内時計をリセットするなど「非視覚の光受容」1)にも用いています。例えば、長距離フライト等で時差ぼけを生じた時に、強い光を目に入れると症状が軽減されることがあり、それは光によって体内時計がリセットされた効果だと考えられます。このような視覚および非視覚の光受容機能において、オプシン2)と呼ばれるタンパク質が最初に光をキャッチする役割を果たしています。オプシンは大きな分子ですが、そのなかにレチナール3)というビタミンAの一種である小さな別の分子が結合すると光をキャッチできるようになります(図1A)。
哺乳類の体内時計が光でリセットされるためには、目の中にある網膜神経節細胞において、メラノプシンというオプシンが青色光を受容することが重要です。そのため、パソコン画面やスマートフォンからの青色光が引き起こすとされる睡眠障害に、メラノプシンが関わる可能性が注目されています。興味深いことに、メラノプシンは脊椎動物の視覚を担うオプシン(視物質と呼ばれています)よりも、むしろハエやイカなど無脊椎動物の視物質に似ています(図1B)。しかし、メラノプシンは視物質とは全く異なる光受容機能を担うため、「非視覚」の機能に適した特徴を持つと考えられてきました。しかし、具体的にどのような特徴を持つのかについては、よくわかっていませんでした。
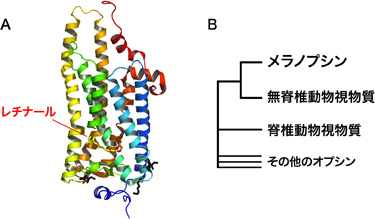
図1A:メラノプシンに近縁なイカの視物質の立体構造(PDB登録コード2Z73)。
タンパク質に低分子レチナールが結合している。
メラノプシンにおいてレチナールの結合強度に影響する3箇所の位置を黒色で示した。
図1B:オプシンの分子系統関係。メラノプシンは無脊椎動物の視物質と、より似ている。
マウスのメラノプシンと無脊椎動物ハエトリグモの視物質について、それらの分子レベルの特徴を比較しました。その結果、哺乳類の体温に近い37℃に保持すると、ハエトリグモの視物質は大きな変化を示しませんが、マウスのメラノプシンは光を受容するために必要なレチナールとの結合が不安定で、自発的に放出することで光を受容できなくなっていくことを見出しました(図2)。このメラノプシンの特徴は、周辺の光環境を感知する機能を果たす上で、感度が高すぎて細胞応答がすぐに飽和してしまうことを防ぐ(光の感度をあえて下げる)ために重要であると考えられます。
興味深いことに、ヒトのメラノプシンはマウスの場合と比べても、レチナールとの結合がいっそう(10倍程度)弱くなっていました(図2)。このように哺乳類の中でも大きな違いがあるため、ヒト以外の霊長類(サル)が持つメラノプシンについてもレチナールの結合の強さを調べるとともに、メラノプシンのアミノ酸配列を人為的に変化させることで、具体的にどの配列の違いがレチナールとの結合の強さ(弱さ)を変えているのかを解析しました。その結果、霊長類の種間でもメラノプシンとレチナールとの結合強度には大きな違いがあり、3箇所のアミノ酸の違いが、結合強度の違いの大部分を生むことがわかりました。この3箇所のアミノ酸を、様々な哺乳類のメラノプシンで比較することにより、類人猿(ヒト・チンパンジー・テナガザルなど)メラノプシンが、分子進化の過程でレチナールとの結合を弱める配列を獲得・保持していることが示唆されました。つまり類人猿への進化過程で、メラノプシンが光を受容しにくくなるようになったことを示唆しています。このことは、ヒトを含めた類人猿が明るい環境で生活するため、メラノプシンへの光入力が強くなることへの適応であると推測できます。
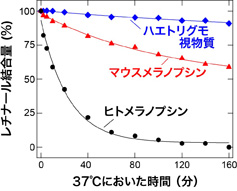
図2:哺乳類メラノプシンと無脊椎動物視物質とのレチナール結合強度の比較。37℃に保持したときのレチナール結合量の変化を示した。
本研究では、メラノプシン分子には、自発的に光を受容しなくなる特徴があることを見出しました。このメラノプシンの特徴は、個々の動物種が生活環境からの光入力をどのように「適度」に受容するか、という調節に関わると考えられます(図3)。メラノプシンは網膜変性症など視覚を失った人の網膜に導入することで、光受容機能の回復を図る遺伝子治療や、特定の神経細胞に強制発現させることで神経活動を光刺激によって制御する(光遺伝学と呼ばれる)研究手法に利用されています。このような応用利用についても、「どれくらいの感度で光を受容するメラノプシンを用いるのか」という選択肢を提供することで、メラノプシンを用いた治療や研究の発展をより推進することが期待されます。
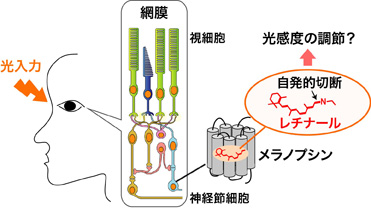
図3:ヒトのメラノプシンにおいて、自発的にレチナールとの結合が切れることによる、光感度の調節の模式図。
1)非視覚の光受容
特定の事物の色・かたち・動きを捉える視覚機能とは異なるタイプの光受容機能。ヒトにおいては、体内時計の光によるリセットや光環境に応じて瞳孔径を調節する機能(瞳孔反射)などがある。多くの場合、視覚を担う視細胞(図3参照)以外の光受容細胞の寄与がある。
2)オプシン
動物の光受容機能の多くを担うタンパク質。様々な神経伝達物質受容体や嗅覚受容体などと共通の構造を持つ。タンパク質だけでは光を受容できないが、レチナールという小分子を結合することで、光受容機能を果たすようになる。
3)レチナール
ビタミンAが酸化されて生じる分子。これがオプシンに結合することで、光受容機能が発現する。栄養不足などでビタミンAが体内で枯渇すると、オプシンへのレチナールの供給が不足し、夜盲症(鳥目)など視覚をはじめとする光受容機能に障害が生じる。
掲載誌:Journal of Biological Chemistry
論文タイトル:Retinal attachment instability is diversified among mammalian melanopsins.
レチナール結合の不安定性は、哺乳類メラノプシン間で多様化している。
著者:Hisao Tsukamoto, Yoshihiro Kubo, David L. Farrens, Mitsumasa Koyanagi, Akihisa Terakita, Yuji Furutani.
掲載日:2015年9月28日 オンライン版に掲載
本研究は、分子科学研究所・生命・錯体分子科学研究領域・古谷グループにより行われました。
本研究は、文部科学省科学研究費補助金・若手研究(B)(#25840122)、生理学研究所共同利用研究、ノバルティス科学振興財団、上原記念生命科学財団のサポートを受けておこなわれました。また、基礎生物学研究所 生物機能解析センター 生物機能情報分析室の機器を使用しておこなわれました。
塚本 寿夫
自然科学研究機構 分子科学研究所 生命・錯体分子科学研究領域 助教
TEL: 0564-55-7453
E-mail: tsukamoh_at_ims.ac.jp
自然科学研究機構・分子科学研究所・広報室
TEL/FAX 0564-55-7262
E-mail: kouhou_at_ims.ac.jp