サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報
お知らせ
2016/12/09
プレスリリース
| アルツハイマー病はアミロイドβ(Aβ)ペプチドが直線状に凝集してできたアミロイド線維が原因と考えられています。このアミロイド線維は一方向にしか伸長しないことが知られていましたが、その理由は分かっていませんでした。今回、自然科学研究機構分子科学研究所の奥村久士准教授と伊藤暁助教はAβアミロイド線維の両末端の構造が異なることを発見し、これがAβアミロイド線維が一方向にしか伸長しない理由であることを明らかにしました。この成果はアルツハイマー病の原因物質が生成されないようにするための薬剤の開発に応用されることが期待されます。本研究結果は、Scientific Reports誌に掲載されます。 |
タンパク質は濃度が高くなると凝集し、アミロイド線維という針状の物質を形成することがあります。アミロイド線維は30 種類以上の病気の原因であり、例えばアルツハイマー病はアミロイドβ(Aβ)ペプチドが凝集してできたアミロイド線維が原因と考えられています。Aβアミロイド線維は図1のように2枚のβシート構造(β1とβ2)を形成しています。その末端に溶液中から別のAβペプチドが次々と結合していくことによってアミロイド線維は伸長していきます(図2)。しかし、アミロイド線維の形成メカニズムはまだよくわかっていません。特にこのアミロイド線維は両端からではなく片方の末端からしか伸長しませんが、その理由もわかっていません。その理由を明らかにするにはまずアミロイド線維の末端の構造を解明する必要があります。
アミロイド線維は直線状にタンパク質が並んだものなのでその末端にはタンパク質が1~2分子しかありません。このためこれまで実際に観測することはできませんでした。そこで本研究ではコンピューター上で分子の運動を計算する分子動力学シミュレーションでAβアミロイド線維の構造と運動を調べました。
その結果、図3のように一方の端では2枚のβシートが近づいたり離れたりしているのに対し、もう一方では近づいたままになっていることを発見しました。その原因は2枚のβシートの形とそれぞれのβシートを作っているAβペプチドが隣のAβペプチドとどの程度強く結合しているかによることも明らかにしました。図1のようにAβアミロイド線維を見るとβ1の真下に同じAβペプチドのβ2があるわけではありません。各Aβペプチドはややねじれていてβ1の真下には隣のAβペプチドのβ2があります。そのため図の左端ではβ1が出っ張っていて、右端ではβ2が出っ張っています。アミロイド線維の末端以外ではβ1とβ2はお互いにしっかりとくっついていますが、左端のβ1と右端のβ2はくっつく相手がありません。そのため、左端のβ1と右端のβ2は共に不安定になると思うかもしれません。しかし、もともとβ1は隣のAβペプチドと強く水素結合してできているのに対し、β2では隣同士のAβペプチドはあまり強く水素結合していません。(これはβ2にはグリシンという水素結合を壊しやすいアミノ酸が含まれているためです。)つまり左端から出っ張っているβ1は真下にβ2がなくても右隣のβ1と強く結合しているため、あまり大きく揺らぎません。一方、右端のβ2は真上にβ1がなく、さらに左隣のβ2ともあまり強く結合していないため大きく揺らぎます。その結果、左端では2枚のβシートが近づいたままになっているのに対し、右端では近づいたり離れたりするのです。このように右端では揺らぎが大きいので新たなAβペプチドが結合しにくく、Aβアミロイド線維が一方向にしか伸長しないことの原因であると考えられます。
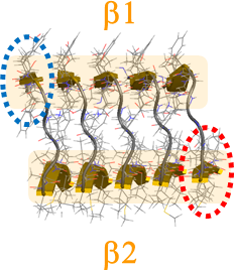
図1 Aβアミロイド線維の構造。オレンジ色の四角で示された部分がβシート構造。上のβシートがβ1、下のβシートがβ2と呼ばれます。Aβアミロイド線維の左端ではβ1が出っ張っているのに対し(青丸)、右端ではβ2が出っ張っています(赤丸)。
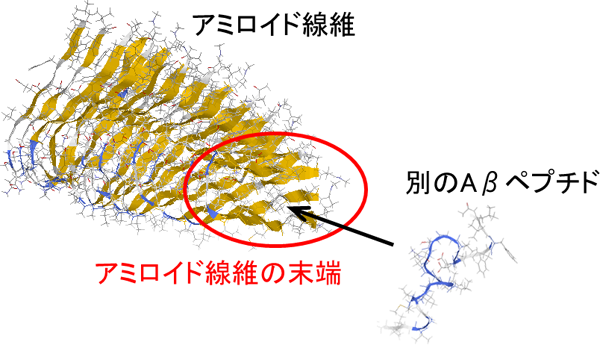
図2 Aβアミロイド線維の伸長の様子。アミロイド線維の末端に別のAβペプチドが1分子ずつ結合することでアミロイド線維が伸長します。
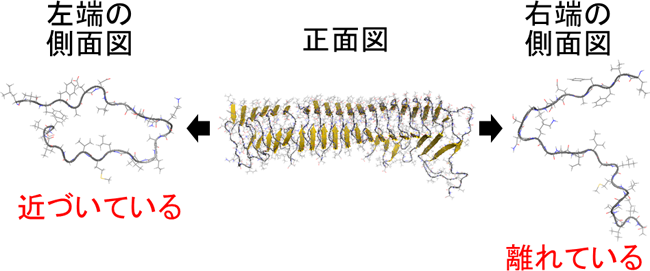
図3 Aβアミロイド線維の一方の末端では2枚のβシート構造はいつも近づいているのに対し、もう一方の末端では2枚のβシート構造は近づいたり離れたりして揺らいでいることが分かりました。
この発見はAβアミロイド線維がなぜ伸長するのかその機構を理解するのに役立ちます。線維が伸長する機構を解明することは、将来的にアルツハイマー病の原因物質が生成されないようにするための薬剤の開発に応用されることが期待されます。
1.分子動力学シミュレーション:
原子や分子の配置から力を計算し、ニュートンの運動方程式を数値的に解くことで仮想的に原子や分子の運動をコンピューター上で再現する計算手法。
2.アミロイド線維:
タンパク質が間違って折りたたみ、凝集することによってできた不溶性の線維で30 種類以上の病気の原因となっている。例えばアルツハイマー病はアミロイドβ(Aβ)ペプチドが凝集してできたアミロイド線維が原因と言われている。
3.βシート構造:
タンパク質中に見られるシート状の構造。図1~3の黄色い部分が相当する。
掲載誌:Scientific Reports 6 (2016) 38422
論文タイトル:
Structural and fluctuational difference between two ends of Aβ amyloid fibril: MD simulation predicts only one end has open conformations
Aβアミロイド線維の両末端の構造と揺らぎの違い:片方の末端だけが開いた構造を取ることが分子動力学シミュレーションにより予測される
著者:Hisashi OKUMURA and Satoru G. ITOH
掲載予定日:2016年12月9日
DOI: 10.1038/srep38422
分子科学研究所計算科学研究センター奥村グループ
奥村久士、伊藤暁
科研費 26102550、岡崎オリオンプロジェクト
奥村久士(おくむらひさし)
分子科学研究所 計算科学研究センター、准教授
TEL 0564-55-7277
携帯 090-1273-2289
E-mail:hokumura_at_ims.ac.jp(_at_ は@に置き換えて下さい)
自然科学研究機構・分子科学研究所・広報室
TEL/FAX 0564-55-7262
E-mail:kouhou_at_ims.ac.jp(_at_ は@に置き換えて下さい)