サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報
お知らせ
2018/09/19
プレスリリース
中村彰彦(自然科学研究機構分子科学研究所 助教)
岡崎圭一(自然科学研究機構分子科学研究所 特任准教授)
古田忠臣(東京工業大学 生命理工学院 助教)
櫻井 実(東京工業大学 バイオ研究基盤支援総合センター 教授)
飯野亮太(自然科学研究機構分子科学研究所 教授)
バクテリアの一種であるセラチア菌が生産するSmChiAは、カニ、エビ、昆虫などの外骨格を形成する結晶性多糖であるキチンを水溶性のオリゴ糖に分解する酵素です。近年、SmChiAはキチン表面を一方向に運動しながら連続的に分解する分子モーターであることが発見されていましたが、その具体的な仕組みは明らかになっていませんでした。
分子科学研究所(分子研)および東京工業大学(東工大)の研究グループは、SmChiAを金ナノ粒子で標識し、全反射暗視野顕微鏡を用いて高い位置決定精度※7と時間分解能で1分子観測することで、キチン分解反応に伴う1 nm間隔のステップ運動を直接可視化することに初めて成功しました。速度論的同位体効果※8を利用してキチンの分解に対応する時定数を決定し、運動中の反応素過程としては速く、律速段階※9ではないことを明らかにしました。また、X線結晶構造解析により運動中間体のキチン結合状態を明らかにし、さらに分子動力学シミュレーションを用いてSmChiAが直進運動する様子を解析した結果、キチンの脱結晶化が運動の律速段階であることを解明しました。さらに、前進・後退の1 nmステップの割合と、反応時定数から計算される分解が起こる確率が同じであることから、SmChiAはレールであるキチンを切断し後退ステップのエネルギー障壁を上げることでブラウン運動(熱ゆらぎ)を前進に偏らせると結論づけました。言い換えると、SmChiAはBurnt-bridge機構により一方向に運動するブラウニアンラチェットモーターであることを導き出しました。
カニやエビなどの甲殻類や昆虫の外骨格、および酵母などの細胞壁を構成するキチンは、N-アセチルグルコサミンが直鎖状につながった多糖類であり、植物が生産するセルロースに次いで地球上に大量に存在する生物由来資源です。キチンは分子鎖が束になり結晶構造を形成するため化学的に安定で、オリゴ糖に分解して資源として利用するには高温高圧での処理が必要となります。他方、バクテリアなどの微生物はキチン分解酵素を体外に分泌し、常温常圧の穏やかな条件下で結晶性キチンを分解して生育の栄養源としています。このため、キチンを資源として有効利用するためのツールとしてキチン分解酵素が注目され、基礎と応用の両面で研究が行われています。
バクテリアの一種であるSerratia marcescensが生産するキチン加水分解酵素SmChiAは、結晶性キチンの分解活性が高い酵素として古くから知られていました。SmChiAはまるでモノレールカーのような、キチン分子鎖を結合するための窪みを持っています(図1)。高速原子間力顕微鏡※10を用いた観察でこれまでに、SmChiAがキチン結晶上を一方向に運動する様子が報告されていました。しかし、どのような仕組みで運動を行っているのかは明らかになっていませんでした。
SmChiAは、結晶表面からのキチン分子鎖の引き剥がし(脱結晶化)、キチンの分解、生成した二糖(キトビオース)の放出、前進運動のサイクルを繰り返していると予想されていました。SmChiAによるキチン分解と運動のメカニズムを解明するためには、これらの素過程を分離して1分子観測する必要がありました。しかし、生成物であるキトビオースのサイズが1 nmと小さいことから、SmChiAの運動素過程(ステップ)の大きさは1 nmと予想され、これまでの手法では解析が困難でした。
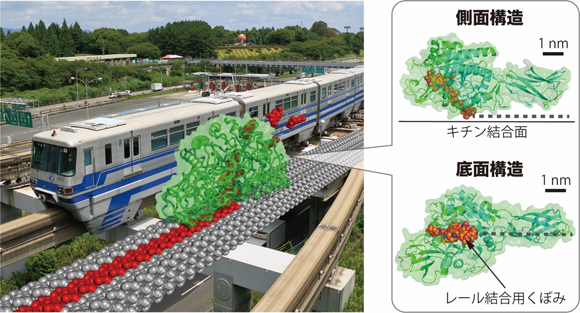
図1:モノレールカーとキチナーゼ(キチナーゼは約10億倍拡大)
分子研および東工大の研究グループは、独自に開発した全反射暗視野顕微鏡を用い、粒径40 nmの金ナノ粒子で可視化したSmChiAがキチン結晶上を運動する様子を、0.3 nmの位置決定精度と500マイクロ秒の時間分解能で1分子観測することに成功しました。高精度・高時間分解能での1分子観測を達成することで、SmChiAが1 nm間隔のステップと停止を繰り返しながら直進運動する様子を直接捉えることができました。SmChiAの運動を詳細に観測し、1 nmずつ連続的に前方へ進むステップだけでなく、後退するステップや後退した状態から復帰するステップも見いだしました(図2)。前進ステップの割合は84%であり、運動方向は前方に大きく偏っていることがわかりました。
また、ステップする前の停止時間の分布の解析および速度論的同位体効果の検証により、各反応素過程の時定数を求めました(図2)。前進ステップが起こる際は、キチンの分解(2.9ミリ秒)と後退ステップ(18ミリ秒)が競合し、前進ステップの割合は時定数の比からも86%と算出され、前述の運動方向の解析から得られた値と一致しました。他方、後退ステップと復帰ステップの前の停止の時定数がほぼ同じであることから、これらの状態(図2AおよびE)の自由エネルギーに差がないこと、および前進・後退のステップは熱ゆらぎで駆動されていることが明らかとなりました。これらの結果は、キチンの分解反応が後退ステップに比べて十分速く起こるために、熱ゆらぎによる方向性のないブラウン運動が一方向に偏ることを示しています。言い換えると、分解反応によってレールであるキチンが1キトビオース分短くなることでSmChiAは後退できなくなり、前に進まざるを得なくなると結論しました。この運動の仕組みは、「退路を絶って強制的に前に進ませる」という意味で、Burnt-bridge(橋を燃やす)ブラウニアンラチェットと呼ばれています。
SmChiA がBurnt-bridgeブラウニアンラチェットであることをさらに確認するため、様々な長さのキチンオリゴ糖との複合体のX線結晶構造解析を行い、運動中間状態でのSmChiAとキチン分子鎖の相互作用を調べました。キチンの結合位置が異なる様々な構造が得られましたが、SmChiAの構造はキチンが結合していない構造とほぼ同じでした。この結果は、SmChiAの構造変化(パワーストローク)により運動が駆動されるのではないことを支持します。また、中間状態のキチンオリゴ糖が結合したSmChiAを初期構造として分子動力学シミュレーションを行い、ブラウン運動でSmChiAが前進・後退運動する様子を再現できました。これらの結果から、SmChiAはタンパク質の構造変化で動くパワーストロークモーターではなく、熱ゆらぎで動くブラウニアンラチェットモーターであることが確認されました。ところで、図2の状態Aから状態Eへの変化は、エネルギーを要する脱結晶化を含んでいるにもかかわらず、何故これらの二状態には自由エネルギー差がなく、熱ゆらぎで移り変わることができるのでしょうか。その理由を理解するため、分子動力学シミュレーションで前進状態と後退状態での可溶性キチンオリゴ糖との結合自由エネルギー差を見積もったところ、前進状態の方がより安定であることが明らかとなりました。この結果から、前進状態で得られるキチン結合の自由エネルギーがキチンの脱結晶化に使われるため、熱ゆらぎで移り変われるのだと結論しました。

図2:前進、後退、復帰ステップの例と反応時定数のまとめ
今回、SmChiAによるキチンの効率的な分解の仕組みを明らかにしたことで、結晶性多糖をより効率的に分解する非天然型キチン分解酵素や類縁のセルロース分解酵素を設計するヒントが得られました。将来は、キチンやセルロースといった生物由来資源の有効利用に貢献できると期待されます。また近年、化学合成された人工分子モーターも創り出されています。ナノメートルサイズの生体・人工分子モーターは慣性を利用できず、常に激しい熱ゆらぎにさらされています。分子モーターを主とする分子機械には、マクロなスケールの機械とは根本的に異なる設計原理が用いられています。今回明らかとなった、ブラウン運動を巧みに利用するSmChiAのメカニズムは、より効率的に働く分子機械の創出に繋がると期待されます。
※1: 全反射暗視野顕微鏡:
光をガラスと水の界面で全反射させることで発生するエバネッセント光を照明に利用し、観察試料からの散乱光を観察する顕微鏡。
※2: Burnt-bridge機構:
後方のレールを取り除くことで後退運動を阻止して前方への運動を達成する仕組み。橋を燃やして退路を断つ、の意味。
※3: X線結晶構造解析:
タンパク質の3次元結晶を調製し、その結晶に対しX線を照射することで立体構造を決定する手法。
※4: 分子動力学シミュレーション:
原子間の相互作用を計算することで、分子の構造変化や振る舞いを、コンピュータを用いてシミュレーションする手法。
※5: ブラウニアンラチェット:
熱ゆらぎによるブラウン運動とその制御を組み合わせて一方向性の運動を達成する仕組み。
※6: 人工分子機械:
化学的に合成されたナノサイズの機械。2016年ノーベル化学賞の対象となった。
※7: 位置決定精度:
顕微鏡観察した像の中心位置をどの程度正確に決定できるかの指標。空間分解能(どれだけ近くにある2つの物体を区別できるか)とは異なる。
※8: 速度論的同位体効果:
重原子同位体では結合の組み換え反応が遅くなる効果。
※9: 律速段階:
一連の化学変化のうち最も遅い段階。この段階の速度で全体の化学変化の速度が決定される。また、他と比べて最も時間のかかる過程(ボトルネック)を表す。
※10: 高速原子間力顕微鏡:
非常に微細な先端を持つ探針で試料表面を高速に走査し、高さの変化として個々のタンパク質の構造変化を実時間で観察する顕微鏡。
掲載誌:Nature Communications
論文タイトル(和訳):Processive chitinase is Brownian monorail operated by fast catalysis after peeling rail from crystalline chitin
(キチナーゼは速い触媒反応による制御で結晶性キチンのレール上を動くブラウニアンモノレールである)
著者(全員):Akihiko Nakamura*, Kei-ichi Okazaki, Tadaomi Furuta, Minoru Sakurai, Ryota Iino* (*責任著者)
掲載予定日:2018年9月19日18時(日本時間)
DOI: 10.1038/s41467-018-06362-3
分子科学研究所と東京工業大学の共同研究
新学術領域研究 発動分子科学 JP18H05424(飯野亮太)
科学研究費補助金JP15H04366, JP16H00789, JP16H00858, JP17K19213 (飯野亮太) JP17K18429, JP17H05899(中村彰彦)
自然科学研究機構 融合発展促進研究プロジェクト J281002(岡崎圭一)
自然科学研究機構 分野間連携研究プロジェクト 01311805(中村彰彦)
新世代研究所 研究助成 RG2709(中村彰彦)
自然科学研究機構分子科学研究所
教授 飯野 亮太(いいの りょうた)
Tel:0564-59-5232 Fax:0564-59-5231
E-mail:iino_at_ims.ac.jp(_at_は@に変換してください)
https://groups.ims.ac.jp/organization/iino_g/
自然科学研究機構 分子科学研究所
研究力強化戦略室 広報担当
Tel:0564-55-7297 Fax:0564-55-7374
E-mail: press_at_ims.ac.jp(_at_は@に変換してください)
東京工業大学 広報・社会連携本部
広報・地域連携部門
Tel : 03-5734-2975 Fax : 03-5734-3661
E-mail : media_at_jim.titech.ac.jp(_at_は@に変換してください)