サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報
お知らせ
2018/10/30
研究成果
すべての生物は、細胞の中の溶液の組成比、特にイオンの濃度をいつも一定に維持しています。細胞外の環境が変化すると、細胞内の溶液組成比が一時的に乱されて、環境変化を刺激として感じ取ることができます。このとき乱された溶液組成を元に戻すため、細胞はATPというエネルギー物質を使って、細胞内のイオンの濃度をコントロールしています。この役割をするタンパク質の一つがV-ATPaseです。
本研究で用いたEh V-ATPaseは、腸内連鎖球菌(Enterococcus hirae)の細胞膜に存在するV-ATPaseで、ナトリウムイオンを選択的に細胞外に排出することが知られています。Eh V-ATPaseは、その部分的な構造がX線結晶構造解析によって明らかにされているだけで、その全体像は不明でした。その理由は、Eh V-ATPaseのような大きなタンパク質粒子の立体像を得る唯一の手段である、従来のクライオ電子顕微鏡法が適用できないためでした。
本研究では、生理学研究所で開発されたゼルニケ位相差クライオ電子顕微鏡を使って、細胞膜から可溶化されたEh V-ATPaseの粒子像を可視化することに世界で初めて成功しました。電子顕微鏡で得られるのは粒子の二次元平面像ですが、多数の二次元像から単粒子解析という方法で三次元の粒子像を立体再構成し、Eh V-ATPaseの全体構造を得ることができました。V-ATPaseは、V1と呼ばれるATPをエネルギーとして動作するモーター部と、Voと呼ばれるイオンを汲み上げるポンプ部が一本の回転子(図中の”Rotor”)によって繋がれた、まさに回転モーターのような構造をしています。本解析の結果、Eh V-ATPaseはV1とVoが2本の固定子(Stalks)で固定されており、V1から伸びる回転子は中心から外れてVoの回転子の先の大きなリング(Ring)と結合していることがわかりました。回転子が回転軸の中心から外れているため、大きくツイストしながら回転すると予想されます。また、抗体を結合させることによって回転子を固定して、このタンパク質モーターが、自然に回転が止まったときの最も安定な構造だけでなく、別の位置で停止している構造を明らかにし、ポンプ動作の別の段階も撮影することができました。
本成果によって、Eh V-ATPaseのナトリウムイオン輸送のためのエネルギー伝達機構を、分子構造の観点から明らかにすることができました。今後さらに詳細な構造研究を進めることによって、V-ATPaseが関係する疾患の治療法や治療薬の開発において重要な情報を提供することができると期待されます。
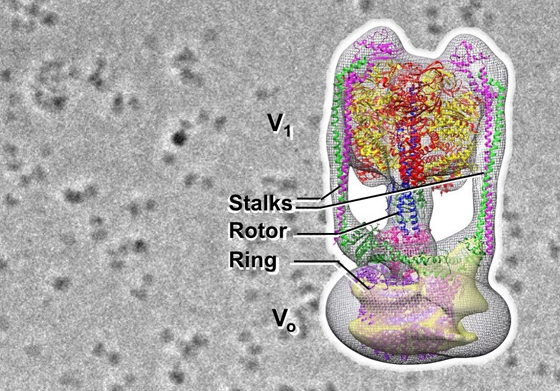
Eh V-ATPaseのゼルニケ位相差クライオ電子顕微鏡像(背景)と三次元構造
飯野亮太(分子科学研究所)
薬師寺 Lica Fabiana、村田武士(千葉大学)
上野博史(東京大学)
高木淳一(大阪大学)
角田 潤、Chihong Song、村田和義(生理学研究所)
科研費 JP15H04366、JP26102507、JP18H05424、JP16K07282, JP16H06280、JP17H03638, JP18H05425
先端バイオイメージング支援プラットフォーム(ABiS)
JST-ERATO百生量子ビーム位相イメージングプロジェクト
生理学研究所共同研究
Title: Off-axis rotor in Enterococcus hirae V-ATPase visualized by Zernike phase plate single-particle cryo-electron microscopy
Authors: Jun Tsunoda, Chihong Song, Fabiana Lica Imai, Junichi Takagi, Hiroshi Ueno, Takeshi Murata, Ryota Iino, Kazuyoshi Murata
Journal: Scientific Reports
Issue: 8:15632
Date: 2018.10.23 publish & online
URL (abstract): https://www.nature.com/articles/s41598-018-33977-9
doi: 10.1038/s41598-018-33977-9