サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報
お知らせ
2019/04/17
プレスリリース
分子科学研究所の岡崎圭一特任准教授とマックス・プランク生物物理学研究所(ドイツ、フランクフルト)のGerhard Hummer教授とWerner Kühlbrandt教授のグループからなる国際研究チームは、トランスポーターNa+/H+交換輸送体が基質イオンを輸送する瞬間のシミュレーションに成功しました。さらに、シミュレーション結果に基づいて、人工的にトランスポーターの基質輸送速度を上げることに成功しました。
本研究成果は、国際学術誌Nature Communicationsに、2019年4月15日付でオンライン掲載されました。
Na+/H+交換輸送体は、ナトリウムイオンとプロトンを細胞内外で交換するトランスポーターで、ヒトにおいてはNHEと呼ばれていて心不全や自閉症などの発症に関与していて、創薬ターゲットにもなっています。従って、その基質イオン輸送メカニズムを解明することは、物理化学のみならず医学的にも重要です。ヒト由来NHEの立体構造はよくわかっていないですが、古細菌由来のもの(PaNhaP)の立体構造は結晶構造解析で最近得られました(図1)。しかしながら、トランスポーターは交互アクセスメカニズム*1でダイナミックに構造を変化させながら基質を輸送しているので、1つの静的な構造のみではその基質輸送メカニズムはわかりません。我々は、もう1つの機能的に重要な構造状態:外向き開構造のモデリングと、基質イオン輸送を引き起こす構造遷移ダイナミクスを、全原子分子動力学シミュレーション*2で解明すべく研究を進めました。
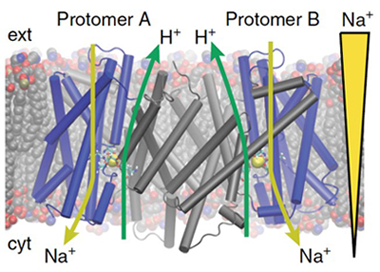
図1. PaNhaPの立体構造。生体膜内でホモダイマー構造をとっているが、それぞれのプロトマーがイオンを輸送する。黄色の球で示されているのが、結合したナトリウムイオン。
まず、基質イオン輸送に必要なPaNhaPの交互アクセスメカニズムについて、内向き開構造は結晶構造解析で得られていましたが、外向き開構造についてはよくわかっていませんでした。そこで、外向き開構造の低分解能電子顕微鏡像を用いた構造モデリングとマイクロ秒オーダーの長時間シミュレーションを行うにより、安定な外向き開構造を得ることに成功しました(図2)。
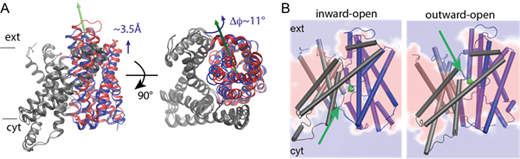
図2. 交互アクセスメカニズムにおける内向き開・外向き開構造。(A) 内向き開・外向き開構造の比較。ダイマー化ドメイン(灰色)を重ねあわせた時のトランスポータードメイン(青色:内向き開、赤色:外向き開)の変化。(B) 内向き開・外向き開構造における水の平均密度(青色:バルク水、赤色:水なし)と結合サイト(緑色)。
交互アクセスメカニズムにおける内向き開・外向き開構造が分かりましたが、それだけではイオンが輸送される前後のことしか分かりません。秒の時間オーダーで起こるイオン輸送を原子レベルで直接的にシミュレーションするのはとてもコストが高く、現在最速のコンピュータを使っても不可能ですが、我々は遷移パスサンプリングという重要な動きが起こる瞬間だけを切り出してシミュレーションを行う技術を応用することで、イオン輸送が起こる瞬間のシミュレーションに成功しました。そして、そのシミュレーション結果から、イオン結合サイトへのゲートの役割を果たしている疎水性残基ペアを発見しました(図3)。
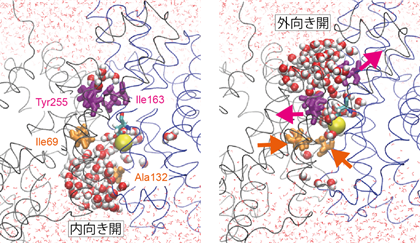
図3. イオン輸送が起こる瞬間のシミュレーションと疎水性ゲート。発見された疎水性ゲート(Ile163-Tyr255)を紫色で示した。
シミュレーション結果から発見された疎水性ゲートに対して、実験的に相互作用を弱める変異を施してやると、驚くことに野生型よりもイオンを2倍以上速く輸送するということが分かりました。なぜ驚くことかというと、重要な部位に変異を施すと機能が低下するのが普通だからです。見方を変えると、このトランスポーターは、輸送速度を犠牲にすることで頑丈で確実にイオンを輸送するように進化してきたと言うことができます。
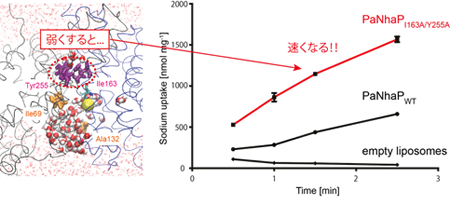
図4. 疎水性ゲートの相互作用を弱くすると、輸送速度が上がる。
今回のNa+/H+交換輸送体やその他のトランスポーターのシミュレーションから、トランスポーターの基質特異性や輸送速度などの機能がどのように制御されているのか、そのデザイン原理を追求していきたいと考えています。そこで得られた知識が、トランスポーターが関与する病気の治療に将来的に役に立つと考えています。
*1 交互アクセスメカニズム:
トランスポーターは、基質結合サイトが膜の片側のみに開いた内向き開・外向き開構造を交互にとることにより、基質を輸送している
*2 全原子分子動力学シミュレーション:
タンパク質分子、生体膜を構成する脂質分子、水分子、イオンなどを構成する全原子の運動をニュートンの運動方程式を数値的に解いてシミュレーションする方法
掲載誌:Nature Communications
論文タイトル:
“Mechanism of the electroneutral sodium/proton antiporter PaNhaP from transition-path shooting”( 遷移パスシューティング手法による電気的中性なNa+/H+ 交換輸送体PaNhaPのメカニズム)
著者:
Kei-ichi Okazaki, David Wöhlert, Judith Warnau, Hendrik Jung, Özkan Yildiz, Werner Kühlbrandt and Gerhard Hummer
掲載日:2019年4月15日(オンライン公開)
DOI:10.1038/s41467-019-09739-0
分子科学研究所、マックス・プランク生物物理学研究所(ドイツ、フランクフルト)
科学技術振興機構 計算物質科学人材育成コンソーシアム
科研費・基盤研究(B)18H02415
岡崎 圭一(おかざき けいいち)
分子科学研究所、特任准教授
TEL:0564-55-7303
E-mail:keokazaki_at_ims.ac.jp (_at_は@に変換してください)
自然科学研究機構 分子科学研究所
研究力強化戦略室 広報担当
TEL:0564-55-7209
FAX:0564-55-7374
E-mail: press_at_ims.ac.jp(_at_は@に変換してください)