サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報
お知らせ
2019/10/25
プレスリリース
分子科学研究所の飯田龍也大学院生(総合研究大学院大学博士課程)、河合文啓特任研究員(当時、現所属は山形大学理学部)、飯野亮太教授、千葉大学の村田武士教授、東京大学の上野博史助教、皆川慶嘉主任研究員の共同研究グループは、高速高精度な1分子解析を用い、回転分子モーターV1の化学力学エネルギー変換機構を解明することに成功しました。類縁の回転分子モーターF1とは機構が大きく異なり、この機構の違いはそれぞれが生体内で果たす役割の違いと密接に関係していることが示唆されました。V1は、生体内でATPの化学エネルギーをイオンの電気化学ポテンシャルに変換するV-ATPaseの一部です。本研究を、V-ATPase全体のエネルギー変換機構の研究へとさらに発展させることで将来、生体に適合したナノサイズの発電装置の開発等に繋がる可能性が期待されます。
本研究は、科学研究費補助金新学術領域研究「発動分子科学」等の助成の一環として行われ、米国生化学・分子生物学会の学会誌『Journal of Biological Chemistry』に2019年9月13日付でオンライン掲載されました。
液胞型ATP加水分解酵素(V-ATPase)は、真核細胞では液胞、エンドソーム、リソソームなどの脂質二重膜小胞、細菌では原形質膜に存在しており、ATP*(アデノシン三リン酸)の化学エネルギーを用いて細胞質側から小胞内(もしくは細胞外)にイオンを能動輸送するイオンポンプとして働いています。V-ATPaseは膜に埋まっている疎水部(Vo)と膜から突出した親水部(V1)にわけられます。V1には3つのATP加水分解部位があり、ATPを分解しながら一方向に回転することで連動したVoが回転しイオンを能動輸送*します。言い換えると、V-ATPaseはナノサイズの回転分子モーターであり、力学的な回転運動をとおして、ATPの化学エネルギーをイオンの電気化学ポテンシャル*に変換することができます。他方、V-ATPaseと類似した構造を持ち、生体内でATPを合成するF型ATP合成酵素(F-ATPase)も回転分子モーターであり、イオンを電気化学ポテンシャルに従って受動輸送*することでFoがATP加水分解時とは逆方向に回転し、連動したF1も逆回転してATPを合成します。
上記のように、V-ATPaseのV1モーターとF-ATPaseのF1モーターは、ATPの化学エネルギーを回転運動の力学エネルギーに変換します。この化学エネルギーと力学エネルギーの変換の仕組み(化学力学共役機構)を解明するため、回転運動を直接観察する1分子解析、および原子レベルで立体構造を明らかにするX線結晶構造解析が精力的に行われてきました。これまでは特に、F1モーターで研究が進んでおり、その化学力学共役機構はほぼ解明されていると言えます。他方、V1モーターについては、X線結晶構造解析により構造の情報は得られていたものの、詳細な1分子解析は行われておらず、化学力学共役機構の詳細は明らかになっていませんでした。
分子科学研究所の飯田龍也大学院生(総合研究大学院大学博士課程)、河合文啓特任研究員(当時、現所属は山形大学理学部)、飯野亮太教授、千葉大学の村田武士教授、東京大学の上野博史助教、皆川慶嘉主任研究員の共同研究グループは、高分解能の構造情報が得られている腸球菌由来のV1 を対象とし、回転運動の詳細な1分子解析を行うことに成功しました。より具体的には、V1モーターの回転軸に直径40 nmの金ナノ粒子を回転運動の可視化プローブとして取り付け、独自に開発した対物レンズ型全反射照明暗視野レーザー顕微鏡を用いて100マイクロ秒の時間分解能で回転運動を1分子解析することに成功しました。
1分子解析の結果、1個のATPの加水分解に相当する120°の回転がさらに、40°と80°のより小さな角度の回転(サブステップ)に分離できることを初めて発見しました(図1)。また、ATP加水分解が遅い変異体を用い、さらに反応生成物のADPを加えた実験では、本来の回転方向(Vo部分からみて反時計回り)とは逆向きに−80°もしくは−40°回転する様子が観察されました(図2)。回転運動中の停止時間の分布を解析することで、40°サブステップ前の停止では3つ、80°サブステップ前の停止では1つ、合計で4つの時定数が得られ、これらの時定数がATP加水分解反応の4つの素過程(ATPの結合、ATPのリン酸結合の開裂、反応生成物ADPの解離、反応生成物リン酸の解離)に対応することを明らかにしました。さらに、1分子解析で得られた結果をX線結晶構造解析による構造情報と組み合わせることで、V1の化学力学共役機構のモデルを提案しました(図3)。
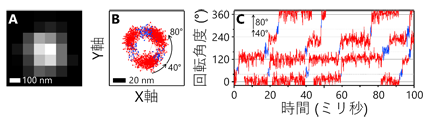
図1.V1の回転運動の例

図2.V1のバックステップの例
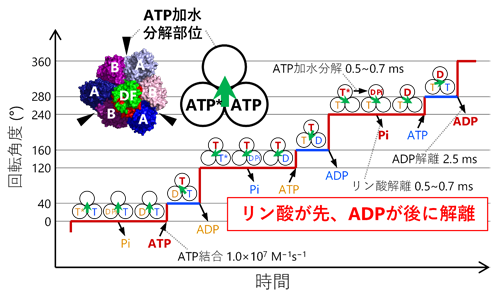
図3.V1の化学力学共役機構
本研究で明らかにしたV1の化学力学共役機構では、反応生成物のリン酸が先にV1から解離し、もう一つの反応生成物のADPは後から解離します(図3)。F1との比較で興味深いのは、F1ではこの順番が逆(ADPが先、リン酸が後)な点です。細胞内にはATPとADPの両方が存在し、しかもATPの濃度はADPの10倍程度高いことが知られています。よってF1(F-ATPase)が細胞内でATP加水分解の逆反応であるATP合成を行うためには、このような細胞内環境下でATPではなくADPを選択的に結合する必要があります。F-ATPaseは逆反応のATP合成時、リン酸を先に結合することでATPの結合を防いでいると考えられます。他方、細胞内でのV1(V-ATPase)の役割はATP加水分解によるイオンの能動輸送(電気化学ポテンシャルの形成)であり、この場合はリン酸とADPのどちらが先に解離しても問題ないと考えられます。このように、F-ATPaseとV-ATPaseの化学力学共役機構の違いは、それぞれの生理的な役割と密に関係していることが示唆されました。
今後はV1部分だけでなく、V-ATPase(VoとV1の複合体全体)を対象とし、エネルギー変換機構、エネルギー変換効率および可逆性について理解したいと考えています。V-ATPaseは、ナノサイズのエネルギー変換装置であり、ナノサイズの発電装置とも言えます。本研究を、V-ATPaseのエネルギー変換の仕組みの研究へとさらに発展させることで将来、生体に適合したナノサイズの発電装置の開発等に繋がる可能性が期待されます。
ATP:
アデノシン3リン酸。ADP(アデノシン2リン酸)とリン酸への加水分解により、生命活動に必要な化学エネルギーが生み出される。
電気化学ポテンシャル:
細胞膜を介したイオンの濃度差によって形成されるポテンシャルエネルギー。
能動輸送:
細胞膜を介したイオンの濃度勾配に逆らう輸送。電気化学ポテンシャルが形成される。
受動輸送:
細胞膜を介したイオンの濃度勾配に従う輸送。電気化学ポテンシャルが消失する。
掲載誌:Journal of Biological Chemistry
論文タイトル:“Single-molecule analysis reveals rotational substeps and chemo-mechanical coupling scheme of Enterococcus hirae V1-ATPase”
(「1分子解析により明らかになった腸内連鎖球菌由来V1-ATPaseのサブステップと化学力学共役機構」)
著者:Tatsuya Iida, Yoshihiro Minagawa, Hiroshi Ueno, Fumihiro Kawai, Takeshi Murata, and Ryota Iino
掲載日:2019年9月13日(オンライン版)
DOI:10.1074/jbc.RA119.008947
分子科学研究所、総合研究大学院大学、千葉大学、東京大学
科学研究費補助金 新学術領域研究 発動分子科学 JP18H05424 (飯野亮太)
科学研究費補助金 JP18H02418, JP18H04755, JP17K19213(飯野亮太)
JSPS特別研究員奨励費 18J23220 (飯田龍也)
飯野 亮太
分子科学研究所 教授
TEL: 0564-59-5230 / FAX: 0564-59-5231
E-mail:iino_at_ims.ac.jp(_at_は@に変換してください)
自然科学研究機構・分子科学研究所 研究力強化戦略室 広報担当
TEL:0564-55-7209 / FAX:0564-55-7374
E-mail: press_at_ims.ac.jp(_at_は@に変換してください)