サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報
お知らせ
2019/11/25
プレスリリース
自然科学研究機構生命創成探究センター(ExCELLS)/分子科学研究所の村木則文助教、青野重利教授ら、および北海道大学の石森浩一郎教授らの研究グループは、ジフテリア菌などのコリネバクテリアが増殖するために必須な鉄イオンを取り込むために利用している「ヘム(*1)取り込みシステム」の構造を決定して、ヘム取り込みの“仕組み”を世界で初めて原子レベルで明らかにしました。本研究の成果は、ジフテリア菌に対する新たな抗菌剤開発のための基礎的な知見を与えることが期待されます。
本研究成果は、英国王立化学会が発行する国際学術誌Chemical Communicationsに掲載されました。
生物にとって必須の微量元素である鉄イオンを自身の細胞内に取り込むため、それぞれの生物ごとに様々な鉄イオン取り込みのための分子システムが存在しています。病原性細菌は、感染した宿主中のヘムタンパク質を主な鉄イオン源として利用するため、ヘムタンパク質中に含まれるヘムを抜き取り、抜き取ったヘムを菌内に輸送するための分子システムを有しています。これまでに何種類かの細菌によるヘム輸送システムについては詳しく研究されていましたが、ジフテリア菌に代表されるコリネバクテリアのヘム輸送システムについては研究が進んでいませんでした。
コリネバクテリアのヘム輸送システムは、細胞表層にあってヘムの結合と輸送を担う二種類のヘム結合・輸送タンパク質(HtaA、HtaB)と細胞内へのヘム輸送に関わるトランスポータータンパク質(HmuT-HmuU-HmuV)から構成されています。HtaAは宿主のヘムタンパク質からヘムを抜き取り、抜き取ったヘムをHtaBに受け渡します。HtaBはHmuTにヘムを渡して細胞内へと輸送します。我々の研究グループは、2016年にHmuTの結晶構造を報告し、コリネバクテリアのヘム輸送システムの一端を解明しました (Muraki et al., Chem. Lett., 2016, Muraki et al., Int. J. Mol. Sci., 2016) 。今回の研究成果では、放射光施設SPring-8のビームラインBL44XUを利用することで未解明だったHtaAとHtaBの結晶構造解析に成功しました。
HtaAとHtaBは、CR(conserved region)ドメインと呼ばれる、ヘムの結合・輸送に関与する新規な構造モチーフを有していました。HtaAはN末端ドメインとC末端ドメインに、それぞれ一つのCRドメインを有している一方で、HtaBは一つのCRドメインから構成されていました。我々は、HtaAのN末端ドメインとC末端ドメイン、HtaBの結晶構造をそれぞれ2.0 Å、1.3 Å、1.7 Å分解能で決定しました。これらは互いに相同性があり、いずれも11本のβストランドと2本の短いαヘリックスから形成されていました。11本のβストランドは逆平行βシートを形成しており、その一部はバレル様構造を形成していました(図1)。
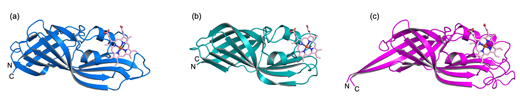
図1 (a) HtaA-N末ドメイン、(b) HtaA-C末ドメイン、(c) HtaBの結晶構造
HtaAおよびHtaBは、どちらもヘム結合型の構造を決定しました。いずれも1分子のヘムがβシートの末端にあるループ領域とαヘリックス(α1)から形成されたヘムポケットに結合していました。ヘムの中心鉄にはチロシンが配位しており、ヘムは5配位構造をとっていました。配位子となるチロシンは、近傍に存在するヒスチジンとの間で水素結合を形成していました。ヘムはチロシンによる配位だけではなく、ヘムのプロピオン酸基を介してセリンやチロシンとの間に水素結合を形成していました。また、ヘム近傍に存在するフェニルアラニンとヘムのピロール環との間には、π-π相互作用が存在していました(図2)。ヘムの軸配位子や、ヘムと相互作用しているアミノ酸はHtaA、HtaBのCRドメイン間において高度に保存されており、これらのアミノ酸がHtaA/HtaBによるヘム結合・輸送の制御において重要な役割を果たしていることが分かりました。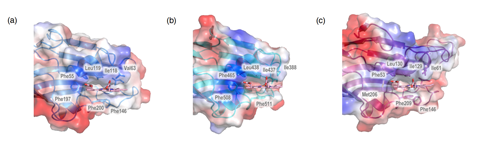
図2 (a)HtaA-N末ドメイン、(b)HtaA-C末ドメイン、(c)HtaB分子中に結合したヘムとタンパク質との相互作用
さらに、我々はヘムの軸配位子であるチロシンと近傍のヒスチジンとの間で形成されている水素結合が、ヘムの結合親和性を制御していることを明らかにしました。チロシンと水素結合を形成しているヒスチジンをアラニンに置換することによって、HtaA/HtaBのヘム結合親和性は大きく低下します。このことを利用し、アポ型(*2)HtaAタンパク質の調製と、その結晶構造の決定にも成功しました。アポ型では、β1ストランド とα1ヘリックスがドメインスワップした二量体構造をとっていました(図3)。ドメインスワップした二量体中では、α1ヘリックスは対となる分子のヘムポケットに近接していました。この二量体構造は、HtaA/HtaBにおけるヘム輸送反応の中間状態のモデル構造と考えられます。すなわち、HtaAとHtaB間でのヘム輸送反応においては、ヘム結合型HtaAとアポ型HtaBが互いにドメインスワップした二量体を形成し、この二量体間でヘムが受け渡しされるという輸送モデルを提唱しました。
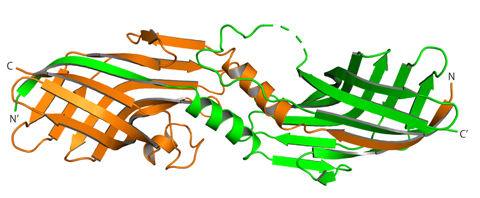
図3 アポ型HtaA二量体の結晶構造。二つの単量体を異なる色で示している
本研究では、非病原性細菌であるCorynebacterium glutamicum由来のヘム取り込みシステムを対象としていますが、同じコリネバクテリウム属に属する病原菌、ジフテリア菌(Corynebacterium diphtheriae)も同じヘム取り込みシステムを利用しています。本研究成果は、ジフテリア菌が増殖するのに必要な鉄イオン(ヘム)の取り込みを阻害することにより、その増殖を阻害する、新しいタイプの抗菌剤の開発に貢献する可能性があります。
1) ヘム
ポルフィリンと呼ばれる環状平面分子の中心に鉄原子をもつ化合物。ポルフィリン環の修飾の種類や位置によっていくつかの種類に分類される。ヘムを分子中に取り込んではじめてその機能が発揮されるタンパク質をヘムタンパク質と呼び、通常、赤色を呈する。酸素運搬体であるヘモグロビン、電子伝達に関与するシトクロム類、酵素活性をもつペルオキシダーゼなどがヘムタンパク質の代表例。
2) アポ型
ヘムなどの補欠分子族を有するタンパク質において、補欠分子族が解離してタンパク質部分のみになった状態。
掲載誌:Chemical Communications
論文タイトル: ”Structural basis for the heme transfer reaction in heme uptake machinery from Corynebacteria”
(「コリネバクテリアにおけるヘム取り込みシステムによるヘム輸送反応の構造的基盤」)
著者: Norifumi Muraki, Chihiro Kitatsuji, Yasunori Okamoto, Takeshi Uchida, Koichiro Ishimori and Shigetoshi Aono
書誌情報:Volume 55, Issue 92, pp 13864-13867 (2019)
DOI:10.1039/C9CC07369H
本研究は、自然科学研究機構生命創成探究センター(ExCELLS)/分子科学研究所、北海道大学が参加した共同研究です。
科学研究費補助金 基盤研究(B) (17H03093)
新学術領域研究「生命金属科学」(19H05762)
青野 重利(あおの しげとし)
自然科学研究機構 生命創成探究センター/分子科学研究所・教授
TEL: 0564-59-5575 / FAX: 0564-59-5576
E-mail:aono_at_ims.ac.jp(_at_は@に変換してください)
自然科学研究機構・分子科学研究所 研究力強化戦略室 広報担当
TEL:0564-55-7209 FAX:0564-55-7374
E-mail: press_at_ims.ac.jp(_at_は@に変換してください)