サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報
お知らせ
2024/01/10
プレスリリース
● ナノメートルスケールの空間に閉じ込められた特殊な赤外光によって単一のタンパク質を観察
● 化学分析に有用な赤外振動スペクトルを単一のタンパク質で計測に成功
● ナノ空間における赤外光とタンパク質の相互作用を理論的に解明
● 赤外光を用いた超高感度・超解像イメージングや単一分子計測などの技術革新に向けた進展に期待
分子科学研究所の西田純助教、熊谷崇准教授を中心とした研究チームは、ナノメートルスケールの空間に閉じ込められた光を用いる近接場顕微分光(注1)の先端計測技術によって単一のタンパク質を観察し、さらに化学分析として有用な赤外振動スペクトルを測定することに成功しました。
赤外光を用いると「分子の指紋」ともよばれる振動スペクトルを計測することができ、化学分析に広く用いられています。近年のナノテクノロジーの急速な発展に伴い、赤外光を用いた超高感度・超解像イメージングへの需要も高まっています。しかしながら、通常の赤外光を用いた顕微分光では、極微量試料の計測やナノメートルスケールの空間分解能を達成することはできません。例えば、一般的に感度が良いとされる赤外顕微分光装置でも、赤外スペクトルの計測には通常100万個以上のタンパク質が必要であり、わずか一つのタンパク質を測定することは不可能です。
研究チームは今回、F1-ATPase(注2)とよばれるタンパク質複合体に含まれるサブユニット(単一タンパク質)を金基板に単離し、赤外近接場顕微分光の測定を大気環境で行いました(図1)。その結果、単一タンパク質の赤外振動スペクトルを取得できることを実証しました。単一タンパク質の計測はタンパク質複合体や膜タンパクなどの高度な機能の解明において重要な技術となります。加えて、研究チームはナノ空間における高度に局在した赤外近接場とタンパク質の相互作用を記述する理論的な枠組みを構築し、得られた信号を定量的に再現することにも成功しました。これらの成果から、赤外光を用いた超高感度・超解像イメージングの技術革新に向けた進展と、生体分子の化学分析をはじめとし、様々なナノ物質への応用が期待されます。
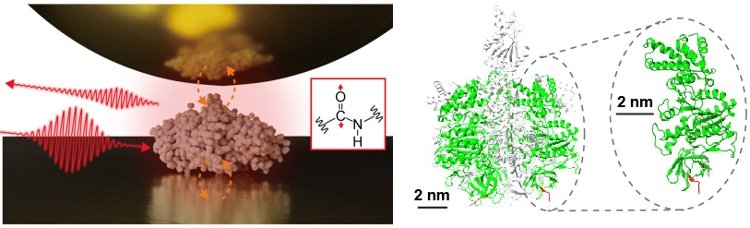
図1 (左)単一のタンパク質を計測する赤外近接場顕微分光のイメージ図。(右)タンパク質複合体F1-ATPaseと今回測定を行ったサブユニットの構造。
本研究成果は学術誌「Nano Letters」に2024年1月9日付でオンライン掲載されました。
赤外光による超高感度・超解像イメージングを行う方法として、近接場分光の一種であるナノ赤外分光法(nano-FTIR、注3)の技術が近年急速な発展を見せています。nano-FTIRはナノメートルスケールの空間で物質の構造解析、化学分析、物性評価を行うことができるため、基礎科学と産業応用の両面から重要な計測法です。nano-FTIRの応用は多岐にわたるため、その技術の進展は広い分野へのインパクトにつながります。
今回、分子科学研究所のメゾスコピック計測研究センター、生命・錯体分子科学研究領域を中心とした学際的な研究チームはnano-FTIRの高感度化および高分解能化を目的とした新しい技術開発を行い、その応用としてこれまで成し遂げられていなかった単一タンパク質の赤外振動スペクトルの計測に挑戦しました。図2に研究チームが分子科学研究所の装置開発室とも協力して開発したnano-FTIR分光装置の模式図を示しています。赤外光源としては、高度に安定かつそのスペクトル幅が赤外振動分光に最適化されたパルスレーザー光源を用いました。原子間力顕微鏡(AFM)の鋭く尖った金属の探針先端に赤外パルスを照射することでナノスケールに局在した電場を形成します。この赤外近接場と金基板上の単一タンパク質との相互作用に由来する散乱光をフーリエ変換赤外分光光度計(FTIR、注4)のように参照光と干渉させて検出することで、赤外スペクトルを取得することができます。金属探針の先端に局在した近接場に由来する信号の大きさは探針先端と試料の距離に強く依存します。この性質を利用して探針―試料距離を変調(ωAFM)しながら散乱信号を取得し、その調和周波数(nωAFM)で変調されている成分をロックインアンプ(注5)で復調検出しました。これによって赤外近接場に由来する信号を選択的に抽出するだけでなく、より高次の調和次数(n)で変調された信号を解析することで、空間的により強く局在した近接場相互作用に由来する信号を得ることができます。
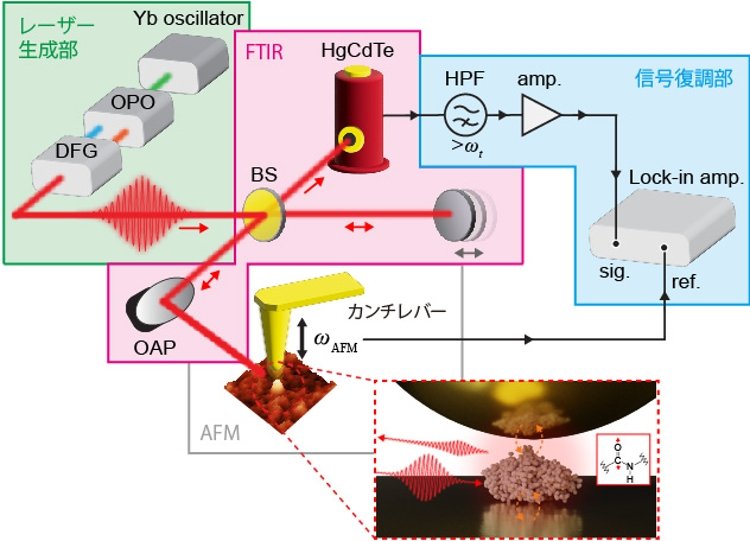
図2 今回開発したnano-FTIR分光装置の模式図。Yb oscillator:イッテルビウムフェムト秒レーザー、OPO:光パラメトリック発振器、DFG:差周波発生器、BS:ビームスプリッター、OAP:軸外し放物面鏡、HgCdTe:赤外検出器、HPF:ハイパスフィルター、amp.:プリアンプ、Lock-in amp.:ロックインアンプ、sig.:検出信号、ref.:参照信号、ωAFM:カンチレバーの共振周波数。
図3(a)と(b)は測定した単一タンパク質のAFM像と赤外スペクトルを示しています。AFMではタンパク質の形状を反映した形状像が観察されており、赤外スペクトルにはタンパク質に含まれるアミド基に由来する振動モード(C=O伸縮振動)の共鳴が1665 cm-1に観測されています。この振動モードはタンパク質の二次構造に敏感であり、その決定に役立つ可能性があることから通常のFTIR分光法やさらに高度な非線形赤外分光法によって幅広く研究されてきました。今回の研究ではこれを単一タンパク質レベルで検出できることを示しました。
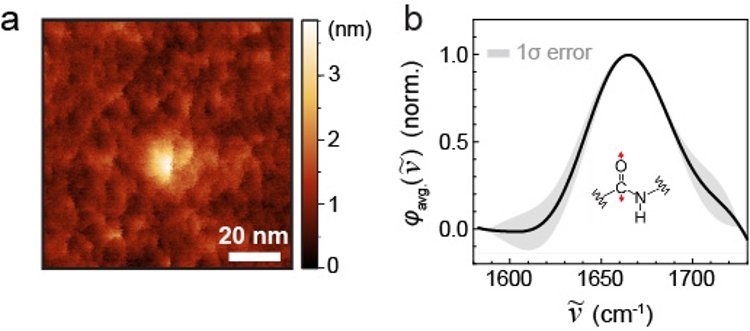
図3 単一タンパク質のAFM像(a)と赤外スペクトル(b)。
さらに研究チームは、ロックインアンプによる赤外近接場散乱の復調を高次の成分まで行う新技術によって空間的により局在した近接場信号を抽出できることを示しました。図4(a)はnano-FTIRにおける赤外近接場散乱の信号を探針と試料との間の距離に対してプロットしたグラフを示しています。グラフから、復調の次数が高くなるにつれて赤外近接場散乱信号の減衰長が短くなっていることがわかります。また、図4(b)に示すように、赤外スペクトルでは振動モードの共鳴が高次でより強くなっていることもわかります。これらの実験結果は高次の復調によって空間的により局在した近接場相互作用を観測していることに相当します。図4(c)は赤外近接場散乱信号の減衰長を復調次数に対してプロットしたグラフを示していますが、6次以上では信号が5 nm以下にまで局在していることがわかります。nano-FTIRを用いたこれまでの研究では通常数十nm程度、最高でも10 nm程度の減衰長(近接場の局在)しか報告されておらず、今回の実験結果はそれを大幅に上回っています。
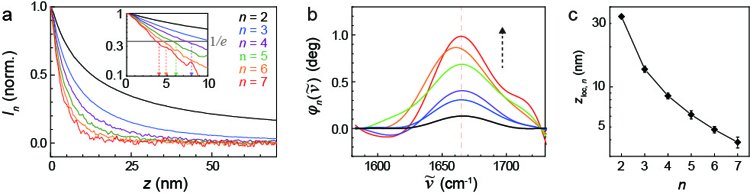
図4 (a)赤外近接場散乱信号(縦軸)を探針-試料間の距離(横軸)に対してプロットしたグラフ。2~7次の復調次数を示している。(b)2~7次の復調次数で測定した赤外スペクトル。(c)(a)のグラフを解析して得られた減衰長(縦軸)の復調次数(横軸)に対する依存性をプロットしたグラフ。
研究チームは得られた実験結果の裏付けと赤外振動スペクトルの定量的な解析を目的として、赤外近接場と単一タンパク質の相互作用についての理論的な解析もマックス・プランク協会フリッツ・ハーバー研究所と協力して行いました。振動モードの共鳴に由来する赤外近接場の応答は系に静電場が与えられた際の分極を計算することで得られます。図5(a)は検証に用いた異なる解析モデルを示しています。図5(b)は理論モデルに基づいて計算した赤外振動スペクトルを示しており、実験で観測されたように高次の復調次数で分子振動による共鳴がより強くなっています。さらに、計算結果と実験結果を比較したところ、図5(c)に示すように探針先端の形状を顕わに扱い、かつ探針の全体的な形状も取り入れた実際の状況に最も近いモデル(EMPD)において特によい一致が得られることがわかりました。
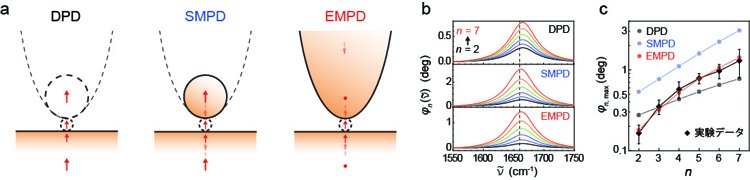
図5 (a)実験結果を再現するために用いた解析モデル。DPD:二重点双極子モデル、SMPD:球形鏡-点双極子モデル、EMPD:楕円鏡-点双極子モデル。(b)計算で得られた単一タンパク質の赤外スペクトル。(c)赤外スペクトルのピーク値(縦軸)を復調次数(横軸)に対してプロットしたグラフ。黒菱形:実験データ、黒丸:DPDモデル、青丸:SMPDモデル、赤丸:EMPDモデル。
赤外分光は物質の構造、物性、機能を調べるための汎用的な分析手法として物理、化学、生物、医療の分野で応用されています。ナノテクノロジーの発展によって、ナノ顕微分光技術はより重要性を増しています。本研究成果は、赤外光を用いた次世代の超高感度・超高解像イメージングに向けた進展につながり、生体分子をはじめ、多様なナノ物質への応用が期待されます。
(注1) 近接場顕微分光:鋭く尖った金属の探針先端に発生する近接場(ナノスケールの光)を用いて顕微分光を行う技術です。通常の光学顕微鏡では回折限界によって解像度が制限されていますが、近接場を用いることではるかに高い解像度で物質を観察することができます。
(注2) F1-ATPase:細胞のエネルギー代謝において重要な酵素で複数のサブユニットから成るタンパク質複合体です。モーターのように回転することで細胞のエネルギー通貨として機能するアデノシン三リン酸を合成します。
(注3) ナノFTIR分光(nano-FTIR)法:通常の赤外顕微鏡では,回折限界によりマイクロメートルオーダー以下のスケールは観察することはできません。赤外近接場光顕微分光では金属探針に赤外光を照射し,発生する近接場によって試料を観察することでナノメートルオーダーの空間分解能を実現できます。原子間力顕微鏡(AFM)と組み合わせて計測することで,試料の構造と,赤外領域の光学情報をナノスケールで同時取得できます。
(注4) フーリエ変換赤外分光光度計(FTIR):試料に赤外光を照射し、透過または反射した光量を測定する機器です。
(注5) ロックインアンプ:非常に微弱な信号を検出し増幅するための電子機器です。アナログ信号に含まれる特定の周波数の微弱な成分を選択的に検出して増幅することができる高感度な測定装置です。ノイズが多い環境下でも正確な測定を可能にするため、微弱信号検出に広く利用されています。
掲載誌:Nano Letters
論文タイトル:Sub-tip-radius near-field interactions in nano-FTIR vibrational spectroscopy on single proteins
著者:Jun Nishida*, Akihiro Otomo, Takanori Koitaya, Akitoshi Shiotari, Taketoshi Minato, Ryota Iino, Takashi Kumagai* (*責任著者)
掲載日:2024/01/09
DOI:doi.org/10.1021/acs.nanolett.3c03479
本研究は自然科学研究機構分子科学研究所の西田純助教、熊谷崇准教授を中心とした研究チームにより行われました。
共著者
大友章裕 助教(分子科学研究所)
小板谷貴典 助教(分子科学研究所(研究当時)、現職:京都大学理学研究科化学専攻・准教授)
湊丈俊 主任研究員(分子科学研究所)
飯野亮太 教授(分子科学研究所)
塩足亮隼 グループリーダー(マックス・プランク協会フリッツ・ハーバー研究所)
本研究は、JST創発的研究支援事業(JPMJFR201J)、自然科学研究機構先端光科学研究分野プロジェクト(01213008および 01212204)、科研費(19J24684)のサポートを受けて行われました。
西田 純(にしだ じゅん)
自然科学研究機構 分子科学研究所 メゾスコピック計測研究センター 助教
TEL:0564-55-7412
E-mail:nishida_at_ims.ac.jp
熊谷 崇(くまがい たかし)
自然科学研究機構 分子科学研究所 メゾスコピック計測研究センター 准教授
TEL:0564-55-7410
E-mail:kuma_at_ims.ac.jp
(_at_は@に変換してください。)
自然科学研究機構・分子科学研究所・広報室
TEL:0564-55-7262
E-mail:kouhou_at_ims.ac.jp
(_at_は@に変換してください。)