サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報
お知らせ
2024/11/21
プレスリリース
・ATP合成酵素による ATP合成機構の解明は、数十年の長きにわたり研究されてきた重要な生命科学の課題の一つです。本研究により、水素イオンの流れによる回転機構が明らかになり、ATP合成機構の解明に必要な重要なピースの一つが埋まりました。本研究で用いた好熱菌由来ATP合成酵素は、ミトコンドリアにあるATP合成酵素とまったく同じものではありませんが、基本的な部分の構造は共通であり、今回の知見はミトコンドリアにあるATP合成酵素にも当てはまると考えています。
・ATPは、生命にとって最も重要なエネルギー物質であり、細胞のミトコンドリアに存在するATP合成酵素という巨大なタンパク質によって合成されます。この酵素は、生体膜を横断する水素イオンの流れを回転力に変換し、その力でATPを生成しますが、これまで水素イオンの流れがどのようにしてATP合成酵素を回転させるのか、その詳細な分子メカニズムは不明でした。
・今回の研究で得た研究手法を、我々の細胞にあるミトコンドリアの ATP合成酵素の研究に 適応し、糖尿病などの代謝やミトコンドリア異常が原因である疾病の治療につながる知見を得ていきます。
京都産業大学生命科学部 横山 謙 教授、西田結衣さん(修士課程2年生)、京都工芸繊維大学応用生物学系 岸川 淳一 准教授、自然科学研究機構分子科学研究所/総合研究大学院大学 岡崎 圭一 准教授らのグループは、クライオ電子顕微鏡法1)と分子動力学シミュレーション2)を用いて、好熱菌由来のATP3)合成酵素4)の詳細な構造とその回転メカニズムを明らかにしました。
ATP(アデノシン三リン酸)は、生命にとって最も重要なエネルギー物質であり、細胞のミトコンドリアに存在するATP合成酵素という巨大なタンパク質によって合成されます。この酵素は、生体膜を横断する水素イオンの流れを回転力に変換し、その力でATPを生成します。これまで、水素イオンの流れがどのようにしてATP合成酵素を回転させるのか、その詳細な分子メカニズムは不明でした。しかし、本研究では、ATP合成酵素の回転力を発生させる膜内在部分(Vo部分)の詳細な構造をクライオ電子顕微鏡で解明し、回転力発生に重要な役割を果たすアミノ酸残基の向きを特定しました。さらに、Vo部分の構造を基に分子動力学シミュレーションを行い、水素イオンの流れによる回転メカニズムを解析しました。その結果、回転リングにある特定のアミノ酸残基の荷電状態の変化が回転力発生に重要であることがわかりました。ATP合成酵素は、ヒトから細菌に至る幅広い生物界に存在するタンパク質です。本研究で特定されたアミノ酸残基はすべてのATP合成酵素にほぼ保存されており、この発見は生命がATPを合成する最も重要な仕組みの解明に貢献するものです。本成果は、2024年11月20日(水)19:00(日本時間)に国際学術誌「Nature Communications」にオンライン掲載されました。
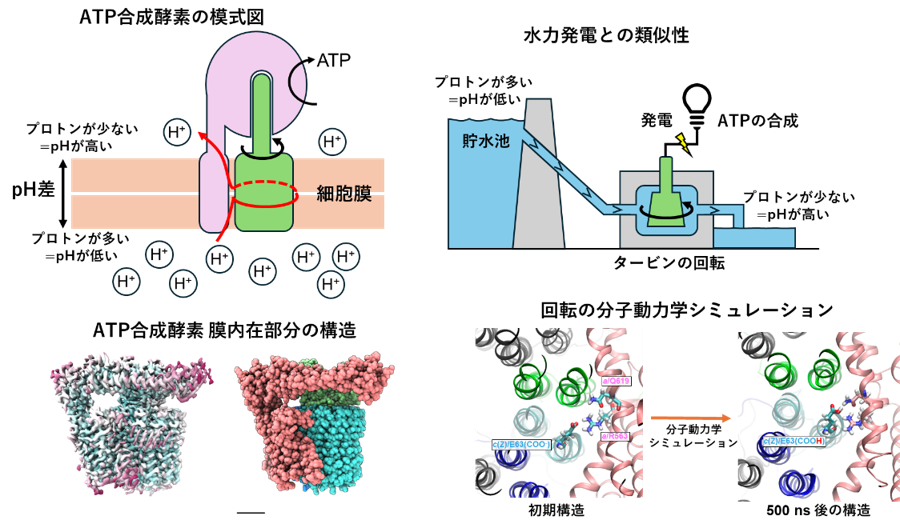 図1. ATP合成酵素の構造解析と分子動力学シミュレーション
図1. ATP合成酵素の構造解析と分子動力学シミュレーション
ATPは、生命のエネルギー通貨として生体内の様々な反応を進める重要な分子です。我々の細胞では、炭水化物や脂肪が細胞内で分解されると、ミトコンドリア内膜を横断して水素イオンを移動させるプロトン駆動力が発生し、これを使って ATP合成酵素がATPを合成します。
ATP合成酵素は、膜に埋まった膜内在性部分と膜から突き出た親水性部分からなります(図2)。膜内在性部分では、プロトン駆動力による水素イオンの移動により、リング構造が分子内部で回転し、親水性部分の軸部分がつられて回転することによりATPが合成されます(図2AB)。親水性部分でのATP合成反応の詳細については、これまでの研究によりほぼ解明されている一方で、膜内在性部分での水素イオンの流れによる回転機構は、その詳細な構造が不明なこともあり、未解決の課題として残されていました。本研究では、膜内在性部分における水素イオンの流れによる回転機構の解明を目的として、ATP合成酵素の膜内在性部分の詳細な構造を決定し、その構造情報に基づいた分子動力学シミュレーションを行いました。
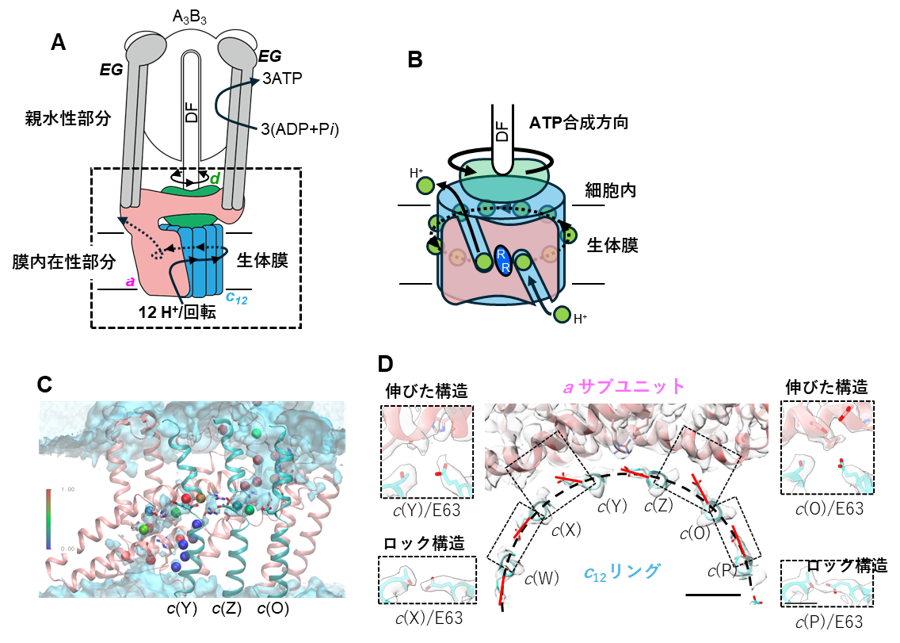 図2.好熱菌由来ATP合成酵素の立体構造。(A)好熱菌由来ATP合成酵素の模式図。親水性部分と膜内在性部分からなる。膜内在性部分は、a サブユニット、c12リング、d サブユニット、EG サブユニットからなる。a サブユニットに対して、c12リング・d サブユニット・DFサブユニットの複合体が回転する。回転に伴い、親水性部分でATPが合成酵素される。(B)膜内在性部分の模式図。a サブユニットには細胞内、細胞外に開いたハーフチャネルが開いており、ハーフチャネルを介して、プロトンの結合と解離が起こる。中央にあるRは、アルギニン残基でハーフチャネルが繋がらないようにバリアとして働く。(C)同定した水分子を球で示した。球の色は、分子動力学シミュレーションによる存在確率の高さを示す(赤(高)←→(低)青)。(D)c12リングのE63 の向き。a サブユニットに面した2つのE63(c(Y)、c(O))の向きが、c12リングの円周に対し外側を向いている。
図2.好熱菌由来ATP合成酵素の立体構造。(A)好熱菌由来ATP合成酵素の模式図。親水性部分と膜内在性部分からなる。膜内在性部分は、a サブユニット、c12リング、d サブユニット、EG サブユニットからなる。a サブユニットに対して、c12リング・d サブユニット・DFサブユニットの複合体が回転する。回転に伴い、親水性部分でATPが合成酵素される。(B)膜内在性部分の模式図。a サブユニットには細胞内、細胞外に開いたハーフチャネルが開いており、ハーフチャネルを介して、プロトンの結合と解離が起こる。中央にあるRは、アルギニン残基でハーフチャネルが繋がらないようにバリアとして働く。(C)同定した水分子を球で示した。球の色は、分子動力学シミュレーションによる存在確率の高さを示す(赤(高)←→(低)青)。(D)c12リングのE63 の向き。a サブユニットに面した2つのE63(c(Y)、c(O))の向きが、c12リングの円周に対し外側を向いている。
本研究では、好熱菌Thermus thermophilus5) 由来のATP合成酵素を材料として、クライオ電子顕微鏡法によって、その構造を原子レベルで明らかにしました。クライオ電子顕微鏡法は、膜タンパク質6)の構造決定法として非常に強力な技術であり、ATP合成酵素などの多くの膜タンパク質の構造決定に利用されています。ATP合成酵素全体の構造は、親水性部分と膜内在性部分が相対的に動くため、高分解能の構造を得ることは困難です。本研究では、AT合成酵素全体に加え、膜内在性部分だけを取り出して、その構造解析を行いました。
今回、私達は単離した膜内在性部分の構造を最大分解能7)2.8 Å で決定しました(図1)。その結果、膜内在性部分のaサブユニットとc12リングの間の親水的な隙間に複数の水分子を同定することができました(図2C)。水分子は、プロトンを輸送するうえで道筋となる重要な分子です。また、プロトンを輸送するために重要なc12リングのアミノ酸残基(63番目のグルタミン酸/E63)が、プロトンの結合状態によって向きがことなることを確認しました(図2D)。特に、親水的な隙間に存在している3つのE63は、水素イオンを離した電離状態になっており、真ん中の E63(c(Z))が a サブユニットのアルギニン残基と静電的に強く結合していることが確認されました。(図2D c(Y)、c(Z)、c(O))。そこで、その3つのE63の電離状態に着目し、分子動力学シミュレーションにより、3つのE63の電離状態が回転に及ぼす影響を検証しました。c(Z)のE63 を水素イオンが結合した状態にすると、シミュレーション中でc12リングがaサブユニットに対して、約10°回転しました(図3)。また、c(Z)のE63に水素イオンが結合しない状態で、c12リングを強制回転させると、リングと a サブユニット間の相互作用が強くなりスムーズにリングが回転しないことが示されました(図3)。また、c(Z)をはさむc(Y)、c(O)のE63のプロトン結合状態も回転に影響することもわかりました。これらの結果から、リングに存在する3つのE63 の荷電状態が水素イオンの流れによって不均一になり、そのためリングのブラウン運動の方向に偏りができ、リングが一方向に回転することが示唆されました(図4)。
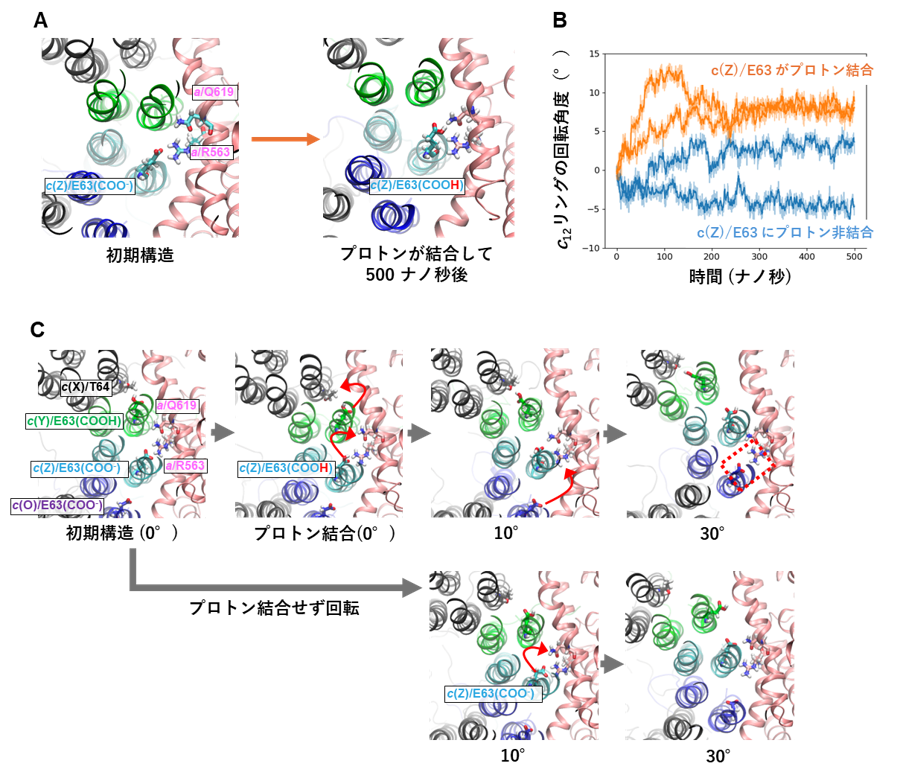 図3.分子動力学シミュレーションによるc12リングのE63のプロトン結合状態の回転への影響。(A)c(Z)/E63にプロトン結合させ、シミュレーションを行うと、約10°回転した。(B)c(Z)/E63のプロトン結合状態の違いによる回転の違い。プロトン結合状態では約10°回転する(オレンジ)が、非結合状態ではほとんど回転しない。(C)シミュレーション上で、c12リングを強制的に回転させ、c(Z)/E63のプロトン結合状態の違いによる影響を観察した。プロトン結合条件では、アミノ酸残基の相互作用相手が順番に変わり、スムーズに回転する(赤矢印)。プロトンが結合していない状態では、相互作用相手を変えることができず、30°回転させるとc12リングが歪んでしまった。
図3.分子動力学シミュレーションによるc12リングのE63のプロトン結合状態の回転への影響。(A)c(Z)/E63にプロトン結合させ、シミュレーションを行うと、約10°回転した。(B)c(Z)/E63のプロトン結合状態の違いによる回転の違い。プロトン結合状態では約10°回転する(オレンジ)が、非結合状態ではほとんど回転しない。(C)シミュレーション上で、c12リングを強制的に回転させ、c(Z)/E63のプロトン結合状態の違いによる影響を観察した。プロトン結合条件では、アミノ酸残基の相互作用相手が順番に変わり、スムーズに回転する(赤矢印)。プロトンが結合していない状態では、相互作用相手を変えることができず、30°回転させるとc12リングが歪んでしまった。
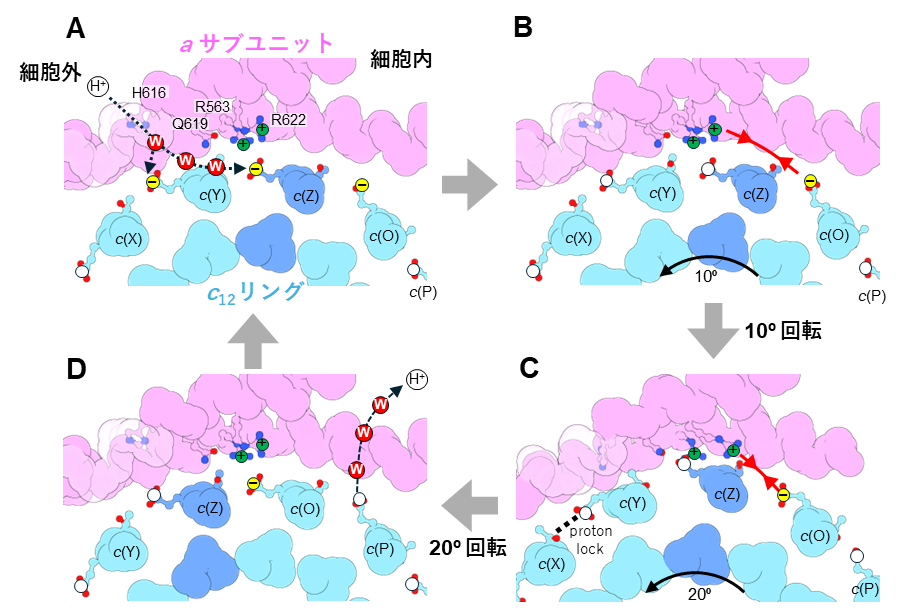 図4.ATP合成酵素の回転の分子メカニズム。a サブユニットとc12リングの界面の拡大図を示す。c12リングのE63を、白丸と黄丸でしめす。白丸はプロトンが結合しており、電気的に中性、黄丸はプロトンが結合しておらず、電気的にマイナスの電荷を持つ。(A)水分子を介して、E63が細胞外からプロトンを受け取ることで、プロトン結合状態になる。(B)プロトンが結合することで、プラスの荷電を持つアルギニンとの結合が弱まり、10°回転する。(C)マイナスの電荷を持つc(O)/E63がアルギニンに近づくことでお互いに引き合い、更に20°回転する。(D)c(P)/E63からプロトンが解離することで、マイナスの電荷を持つ。次にc(O)/E63が細胞外からプロトンを受け取る。このように連続的にプロトンの受け渡しが行われることで、回転が生み出される。
図4.ATP合成酵素の回転の分子メカニズム。a サブユニットとc12リングの界面の拡大図を示す。c12リングのE63を、白丸と黄丸でしめす。白丸はプロトンが結合しており、電気的に中性、黄丸はプロトンが結合しておらず、電気的にマイナスの電荷を持つ。(A)水分子を介して、E63が細胞外からプロトンを受け取ることで、プロトン結合状態になる。(B)プロトンが結合することで、プラスの荷電を持つアルギニンとの結合が弱まり、10°回転する。(C)マイナスの電荷を持つc(O)/E63がアルギニンに近づくことでお互いに引き合い、更に20°回転する。(D)c(P)/E63からプロトンが解離することで、マイナスの電荷を持つ。次にc(O)/E63が細胞外からプロトンを受け取る。このように連続的にプロトンの受け渡しが行われることで、回転が生み出される。
ATP合成酵素による ATP合成機構の解明は、数十年の長きにわたり研究されてきた重要な生命科学の課題の一つです。今回の研究により、水素イオンの流れによる回転機構が明らかになり、ATP合成機構の解明に必要な重要なピースの一つが埋まりました。本研究でもちいた好熱菌由来ATP合成酵素はミトコンドリアにあるATP合成酵素とまったく同じものではありませんが、基本的な部分の構造は共通であり、今回の知見はミトコンドリアにあるATP合成酵素にも当てはまると考えています。多くの生物の生存に欠かせないATP合成酵素は、代謝や疾病にも関係する重要な創薬ターゲットタンパク質であり、その分子機構と詳細な構造解明は、将来的な医薬応用にも繋がります。今後は、今回の研究で得た研究手法を、我々の細胞にあるミトコンドリアの ATP合成酵素の研究に適応し、糖尿病などの代謝やミトコンドリア異常が原因である疾病の治療につながる知見を得ていきます。
本研究は、文部科学省科学研究費助成事業(23H02453 [横山]、 20K06514 [岸川]、 22H02595 [岡崎])、武田科学振興財団 [横山]、AMED研究事業 (BINDS) JP17am0101001、 文部科学省ナノテクプラットフォーム事業、 科学技術振興機構 戦略的創造研究推進事業(CREST) (JPMJCR1865 [光岡])の支援を受けて行われました。
タイトル:
Rotary mechanism of the prokaryotic Vo motor driven by proton motive force.
(原核生物Voモーターのプロトン駆動力による回転メカニズム)
著者:
【筆頭】Jun-ichi Kishikawa1,2,3, Yui Nishida1, Atsuki Nakano1, Takayuki Kato2, Kaoru Mitsuoka4,
【責任】Kei-ichi Okazaki5, 6* and Ken Yokoyama1*
所属:
1Department of Molecular Biosciences, Kyoto Sangyo University
2Institute for Protein Research, Osaka University
3present affiliation; Department of Applied Biology, Kyoto Institute of Technology
4Research Center for Ultra-High Voltage Electron Microscopy, Osaka University
5Research Center for Computational Science, Institute for Molecular Science, National Institutes of Natural Sciences
6Graduate Institute for Advanced Studies, SOKENDAI
掲載誌:Nature Communications
DOI: 10.1038/s41467-024-53504-x
研究に関すること
岸川 淳一(きしかわ じゅんいち)【筆頭著者】
京都工芸繊維大学・准教授
TEL: 075-724‐7532
E-mail: kishijun_at_kit.ac.jp(_at_は@に変換してください。)
岡崎 圭一(おかざき けいいち)【責任著者】
自然科学研究機構分子科学研究所/総合研究大学院大学・准教授
TEL: 0564-55-7468
E-mail: keokazaki_at_ims.ac.jp(_at_は@に変換してください。)
横山 謙(よこやま けん)【責任著者】
京都産業大学生命科学部・教授
TEL: 075-705-3043
E-mail: yokoken_at_cc.kyoto-su.ac.jp(_at_は@に変換してください。)
取材に関すること
京都工芸繊維大学 総務企画課広報係
TEL: 075-724-7016
E-mail: kit-kisya_at_jim.kit.ac.jp(_at_は@に変換してください。)
自然科学研究機構分子科学研究所 広報担当
TEL: 0564-55-7209
E-mail: press_at_ims.ac.jp(_at_は@に変換してください。)
総合研究大学院大学 総合企画課 広報社会連携係
TEL: 046-858-1629
E-mail: kouhou1_at_ml.soken.ac.jp(_at_は@に変換してください。)
京都産業大学 広報部
TEL: 075-705-1411
E-mail: kouhou-bu_at_star.kyoto-su.ac.jp(_at_は@に変換してください。)