サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報
[はじめに]
NMRは、核のまわりの局所構造や運動性に関する情報を、原子分解能で非破壊的に得ることができる分光法である。特に固体NMRが対象とする試料では、溶液状態では消失していて観測できない特定の異方的内部相互作用を観測することにより、分子の配向や精密原子間距離情報を得られる特徴がある。我々は固体NMRを 研究手段として、有機低分子、無機材料などの分子材料から、膜タンパク質などの生体高分子を研究対象とし、その解析に有用な測定法、ハードウエアの開発、および分子のキャラクタリゼーションを試みてきた。今回は主に生体中で脂質膜と相互作用して機能を発現する膜タンパク質を対象とした研究について紹介する。
[生理的条件下の膜貫通型タンパク質の構造解析]
現在の溶液NMRでは、高磁場化と緩和時間の遅い成分を観測する手法の開発により、膜タンパク質をミセルで可溶化した疑似脂質膜試料の取り扱いが可能である。しかし、ミセルは脂質二重膜ではなく、脂質膜の疎水的環境を近似しているに過ぎない。固体NMRでは試料の回転相関時間の上限は存在せず、膜貫通型タンパク質の構造解析では、その機能が発現しうるベシクルなどの脂質二重膜中に膜タンパク質が再構成された試料を用いる。非配向試料では図1 に示すように、一般に脂質二重膜が層状に組み込まれたマルチラメラベシクルを遠心沈降させたペレット試料を用いる(図1(a))。一方、配向試料は主に2種類存在する:( 1)薄いガラス片上に上述のマルチラメラベシクルを添加して、構成脂質の液晶ゲル相転移点以上の温度でインキュベートするなどの方法により、ガラス平面上に幾重にも脂質膜層が積み重なった配向試料を調製する方法(図1(b))、および(2)特定の飽和長鎖脂質と短鎖脂質を適切な割合で混合して水和し、磁場中で長鎖脂質の液晶ゲル相転移点以上の温度にすることにより生じるディスク状の自発磁場配向膜Bicelle を用いる方法である(図1(c))。後者の場合、良好な配向が得られる測定温度範囲は、一般に脂質の相転移温度から上約10℃という制限が付く。
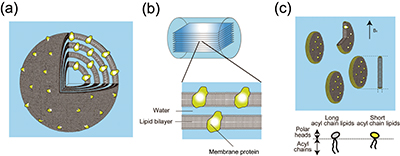
図1 脂質膜試料の模式図。(a) マルチラメラベシクルに再構成された非配向膜タンパク質試料。(b) ガラス薄片上に形成された脂質膜層に再構成された配向膜タンパク質試料。(c) 自発磁場配向膜であるBicelle 膜中に再構成された配向膜タンパク質試料。黄緑色:膜貫通型タンパク質。灰色:長鎖リン脂質。黄色:短鎖リン脂質。
配向試料が調製可能な場合、効率的な解析法が確立されている。特に主鎖がαへリックス構造を取る場合、タンパク質主鎖のアミド窒素を15N標識した試料を用いて、15N化学シフト異方性、および直接化学結合した1Hとの異種核間磁気双極子相互作用を2次元NMRで観測する双極子磁場分離法を適用する。この測定で得られるスペクトルは、PISA wheel[1]と呼ばれるヘリックスのらせん構造を反映した特徴的な円形の信号パターンを示す。このスペクトルの解析により、信号帰属と同時にタンパク質主鎖のへリックス長軸の脂質膜法線軸方向に対する傾斜角、およびその軸の周りの各残基の位置を示す回転角を決定することが可能である。この双極子磁場分離法には多様な測定法が存在するが、一般的に1Hと15N核の双方に連続的なラジオ波を照射する測定法を用いるため、ラジオ波による試料発熱の問題が報告されるようになった。著者はこの試料発熱を著しく減少させつつ、性能は保持する新規測定法の開発なども行ってきた[2,3]。
ところで、一般に少数回膜貫通型タンパク質では会合体を形成し、複数回膜貫通タンパク質でも多量体を形成することが多い。このような場合での立体構造解析には、配向試料で得らえる主鎖の配向情報だけでは不十分で、ヘリックスなどの二次構造主鎖間の距離 情報が必要となる。筆者はインフルエンザAウイルス由来M2 H+チャンネルの解析において、チャンネルの内側を向いているTrpおよびHis側鎖の各々を13C、15N安定同位体標識した試料を調製し、13C-15N磁気双極子相互作用の選択的観測[4] を行った。分子の脂質二重膜中での回転拡散に起因する同相互作用の変調効果を取り入れた解析を行うことにより、核間距離に加え、13C-15N核対ベクトルと膜法線軸の間の角度依存性を新たな構造情報として取得することに成功した。この解析により、図2 に示すように初めて実験的にM2 H+ チャンネルの4量体ヘリックスバンドル構造を決定した[5]。また、この構造を基にM2 H+ チャンネルの作用機構について解析を行った[6]。
上述の配向試料を用いた膜タンパク質のPISA wheel 解析法はデファクトスタンダードな解析手法として定着し、特に少数回膜貫通型タンパク質や、膜貫挿入型ペプチドなどの構造解析研究で高い使用実績を示した。たが、複数回膜貫通型タンパク質では、各構成要素のα へリックスが同様な傾斜角を持つ場合、信号が重なり解析が難しくなる問題がある。この問題はα へリックス毎の選択的同位体標識技術により解決が可能であるが、高度な試料調製技術が要求される。
6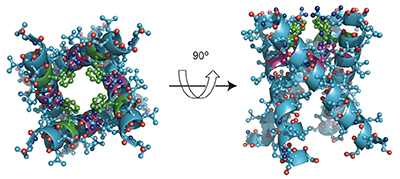
図2 固体NMR解析によって決定したインフルエンザウイルス由来M2 H+ チャンネル膜貫通ドメインの生理活性のある水和脂質二重膜中での立体構造。
[生理的条件下の生体分子の構造解析-膜表在性タンパク質の場合]
膜表在性タンパク質は脂質膜表面に結合して機能を発現するタンパク質である。脂質二重膜を形成するベシクルに膜表在性タンパク質が結合すると、試料の相関時間が長くなるため、溶液NMRではタンパク質の信号が消失して観測できなくなる。このため水溶液中で水溶性リガンドとの結合状態、または単独の状態の解析には溶液NMR、脂質膜表面に結合した状態の解析には固体NMRの測定が各々必要となる。我々は膜表在性タンパク質フォスフォリパーゼC(PLC)-δ1の脂質結合ドメインであるプレクストリンホモロジー(PH)ドメインの構造機能相関の研究を行っている。PLC-δ1は、図3に示すように細胞膜表面に多く存在する脂質群フォスファイノシチドの一つ、フォスファチジルイノシトール4,5二リン酸(PIP2)に特異的に結合・加水分解し、セカンドメッセンジャーとしてイノシトール3リン酸(IP3)、およびジアシルグリセロール(DAG)を放出する。同タンパク質のIP3 への結合状態の立体構造が、X線結晶解析により報告されているが、水溶液中での構造解析報告は存在せず、その機能発現の分子機構について詳細は未だに不明である。
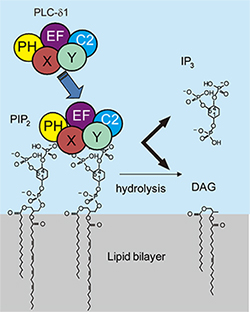
図3 PLC δ-1 の作用模式図。
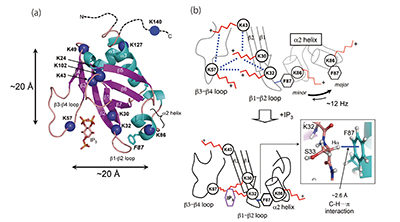
我々はまず、rat 由来のPHドメイン(ratPH)が、PIP2 を含有したミセル、小ユニラメラベシクル、マルチラメラベシクルに結合する際、脂質膜表面の曲率変化に敏感に反応して、その立体構造を変化させることを固体13C-MASNMRを用いた解析により見出した[7]。その後ヒト由来のPLC-δ1 のPHドメイン(hPH)に研究対象を移し、水相でのIP3 結合前後での構造変化について、Lys残基の主鎖アミド基を選択的15N同位体標識した試料を用いて、溶液NMRによりリガンド結合前後の信号シフト解析を行った。その結果、リガンド結合に伴う二次構造変化がリガンド結合部位だけでなく、分子内の遠位の残基まで伝達されるアロステリック効果を持つことを明らかしにした[8]。また、新たに開発したnative ゲル電気泳動法を用いた同タンパク質の熱安定性評価法の解析を行った。その結果、これまで脂質表面に結合する際、非特異的な疎水性相互作用で脂質膜表面にアンカリングすると考えられて来たα2ヘリックス部位がIP3結合時に分子の安定化に寄与することを明らかにした[9]。これらの結果は、同タンパク質が脂質表面のPIP2 よりIP3 の方に高い結合活性を示す事実を説明し、α2ヘリックス部位が脂質結合の際に親和性低下に寄与するという新しい作用機構の提案に至った[8,9]。
一方、hPHの13C固体NMR解析では、脂質結合時に信号が消失する現象が観測された。現段階では、脂質結合状態では、hPHが1Hのデカップリングとの干渉を生じる104-5Hz程度の運動性を持つか、脂質膜との強い結合に起因する不均一な構造への転移、および脂質内部への挿入が考えられる。これは、生化学的実験により報告されている膜挿入仮説と一致する。残念ながら同現象は試料調製直後から始まると考えられ、NMRの信号積算のタイムスケールより速く状態変化を生じるため、時間分解測定を行うことはできない。現在、本結果が単独ドメイン解析によるアーティファクトであるか否かを確認するため、隣接ドメインを共発現したマルチドメインタンパク質での解析準備を進めている。
脂質膜結合状態の膜表在性タンパク質の固体NMRの実験では、以下に示すように試料調製、および測定において実に多くの解決すべき問題が存在する。まず、感度の低い固体NMRで有効な信号を得るため、溶液NMRより単位体積当たりのタンパク質量が高い試料が必要であるが、タンパク質水溶液は濃縮し過ぎると凝集をおこすことが多い。また、膜表在性タンパク質はベシクルの最表面に結合させる必要があり、膜貫通型タンパク質のようにベシクル内部に組み込むことはできない。これは、本タンパク質の直径がマルチラメラベシクル中の水層の厚みと同程度であるため、その水層中で接触を起して人工的な構造変化を生じる可能性があるためである。この様な問題から、膜表在性タンパク質の解析では、試料のほとんどを水と脂質膜が占める極めて低感度な試料を扱わなければならない。スペクトル高感度化のためには高磁場の利用が有用であり、著者は図5に示すような920MHz 超高磁場NMR用固体温度可変MASプローブの開発なども独自に行ってきた。また、ベシクルより単位体積当たりのタンパク質量の増加が可能な、長時間安定的に室温付近で自発磁場配向するBicelle の開発も行った[10]。しかし、この様な地道な改善を行っても、現状では多次元NMR測定をするに十分な検出感度は得られていない。
67
図5 独自に開発した920MHz超高磁場NMR用温度可変MASプローブ、および920MHz超高磁場NMR用超電導マグネット全景。
[今後の展開について]
タンパク質の立体構造の決定のみを目的としてきた構造生物学は終焉を迎え、NMRは機能性分子としてのタンパク質の本質の解析に迫る新たなステージに立っている。これまで紹介したように、膜タンパク質の構造解析の成功には試料調製の寄与が大きい。多くの測定法や解析法が提案されながらも、過去10年間固体NMRによる膜タンパク質の解析数が飛躍的に増加していないのは、試料調製の問題が大きな因子の一つと言える。現在NMRの弱点である低感度を改善するための様々な測定法の開発を行っている。今後これらの温めてきた技術を実用化し、誰もが有用性を認めうる方法論の開発を推し進めていきたいと考えている。以上で紹介した研究は、当グループのメンバーに加え、多くの共同研究者との共同研究で得られた成果であり、全ての共同研究者に感謝の意を表したい。
■参考文献
[1] J. Wang, et.al. J. Magn. Reson. 144 (2000) 162-167.
[2] K. Nishimura, and A. Naito, Chem. Phys. Lett. 402 (2005) 245-250.
[3] K. Nishimura, and A. Naito, Chem. Phys. Lett. 419, (2006)120-124.
[4] K. Nishimura, and A. Naito "REDOR in Multiple spin System" Modern Magnetic Resonance, Springer, The Netherlands (2006)
[5] K. Nishimura, et.al Biochemistry. 41 (2002) 13170-13177.
[6] J. Hu, et al, Proc. Natl. Acad. Sci. 103 (2006) 6865-6870.
[7] N. Uekama, et. al Biochim. Biophys. Acta. 1788 (2009) 2575-2583.
[8] M. Tanio and K. Nishimura, (2013) Biochim. Biophys. Acta. (2013) DOI 10.1016/j.bbapap.2013.01.034
[9] M. Tanio and K. Nishimura, Anal. Biochem. 431 (2012) 106-114.
[10] 西村 勝之、上釜 奈緒子 特願 2009-245245