サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報

膜タンパク質は、脂質二重層からな る細胞膜に存在し、細胞内外の物質や情報のやり取りを行っている(図1)。 イオンポンプと呼ばれる膜タンパク質のはたらきにより、細胞内外でのイオン濃度差が形成される。その濃度差による電気化学ポテンシャルを利用して、 ATP合成酵素は生物のエネルギー通貨と呼ばれるアデノシン三リン酸(ATP)を合成する。また、イオンチャネルは過渡的にナトリウムイオンやカリウムイオンを透過させ、生体電気信号を発 生する。その他にも外部からの刺激を受容し、細胞内に情報を伝達する受容体などもある。このように膜タンパク質は様々な生命活動を実現する基本素子としてはたらいている。
タンパク質は20種類のアミノ酸がペプチド結合により重合した高分子の一種であるが、特定の立体構造へと折り畳まれることにより、活性を持った状態になることが一般的である。タンパク質の立体構造を原子レベルで解明することは、その機能発現の分子機構を理解するのに重要である。タンパク質の立体構造解析では、X 線結晶構造解析やNMRを用いた手法が広く使われているが、最近では電子顕微鏡による単粒子解析でも原子レベルでの構造解析がなされるなど、最先端の技術も開発されている。さらに、タンパク質の機能発現の分子機構を深く理解するためには、タンパク質が動作する過程での構造変化など、動的な側面に注目した研究が重要である。
赤外分光法は分子の振動準位エネルギーに相当する赤外線を用いる分光法の一種である。その手法自体で原子レベルでの構造解析を行うことは不可能であるが、様々な刺激の前後での差スペクトルを計測することで、タンパク質内部に存在する特定のアミノ酸残基1 個や水分子1 個の変化を明らかにすることが可能である(図2)[1-5]。特に、タンパク質内部に埋もれた化学結合や水素結合のわずかな変化を分子振動の変化として鋭敏に捉えることが可能なため、上手く活用できれば、タンパク質の機能発現に伴う微細ではあるが重要な構造変化を見いだすことができる。
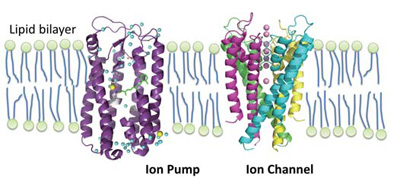
図1 膜タンパク質の結晶構造の一例(左;ハロロドプシン、右;カリウムチャネルKcsA)
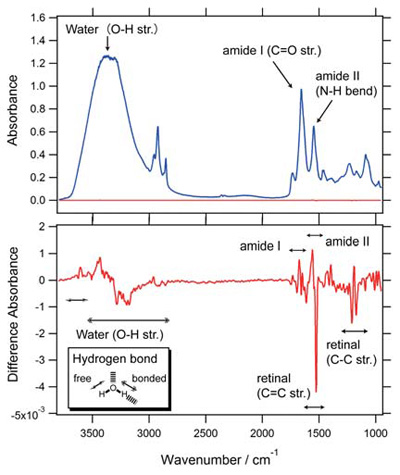
図2 膜タンパク質の赤外吸収スペクトル(青)と光誘起差スペクトル(赤)
最近、動物の行動を光で制御する光遺伝学(オプトジェネティクス)と呼ばれる研究手法に注目があつまっている[2,3]。光開閉イオンチャネルとして機能するチャネルロドプシンにより、神経細胞を興奮させることで、動物の行動が制御できることが示された。また、ハロロドプシンやバクテリオロドプシンでは、逆に鎮静させる作用がある。このような生理作用を実現するチャネルロドプシンやハロロドプシンのイオン透過やイオン輸送の分子機構にも注目が集まっている。
ハロロドプシンは、微生物型ロドプシンの一種であり、光駆動型塩化物イオンポンプとしてはたらく。X 線結晶構造解析により、タンパク質内部に水分子が存在することが示されていたが、その役割はよく分かっていなかった。水分子は水素結合強度の違いに応じてO-H 基の伸縮振動が変化する(図2)。光誘起の赤外差スペクトルを時分割計測し、3600 cm-1 以上の高波数領域において、水のO-H 伸縮振動の各中間体形成時における変化を捉えた。そのO-H 伸縮振動の振動数や強度の変化から、塩化物イオンの取込みと放出の際に、水素結合の相手がいないO-H 基を持つ水分子が増えることを明らかにした(図3)[6]。負電荷を持ったイオンがタンパク質内部で安定化される際に水分子が積極的に関与していることを示唆する結果である。
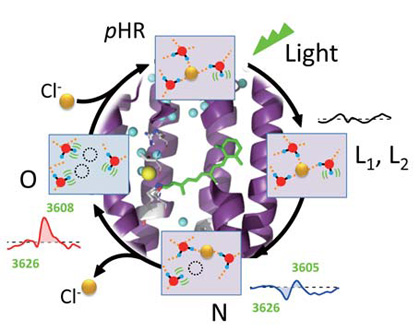
図3 ハロロドプシンの光反応中に変化する水分子
チャネルロドプシンは、光開閉カチオンチャネルとしてはたらく。チャネルロドプシン1 および2(以降、ChR1およびChR2)と2種類存在するが、オプトジェネティクスではChR2 がよく使われている。X 線結晶構造解析により、ChR1 とChR2 のキメラタンパク質の構造が解かれ、ChR2 における機能改変変異体の設計などに活用されてきた。我々は、このキメラタンパク質の光誘起構造変化を詳細に解析することで、ChR2 とキメラタンパク質とでは、構造変化が大きく異なっていることを明らかにした[7]。また、イオン選択やイオン透過に重要と考えられているGlu129(ChR2 ではGlu90)のプロトン化状態についても、ChR2 との差異を明らかにした。ChR2 の立体構造は未解明であるが、我々の結果はキメラタンパク質のものとは異なっていることを示唆している。
チャネルロドプシンやハロロドプシン以外にも様々な微生物型ロドプシンが見つかってきている。一般的に微生物型ロドプシンは7 回膜貫通型ヘリックスからなり、通常、all-trans型レチナールを発色団として結合する。trans-cis 異性化によって引き起こされるタンパク質の構造変化によって、イオンポンプ、イオンチャネル、光センサーと様々な機能を発現することが知られている。須藤雄気博士(岡山大学・教授)のグループは11-cis 型レチナールを結合することが可能なMiddle rhodopsin(MR)を発見した。脂質膜再構成試料ではall-trans型レチナールを結合したMR が大勢を占めるが、それについて解析を行った。その結果、これまでに見られたことのないβ シートに由来すると思われるamide バンドの変化を観測することに成功した[8]。all-trans レチナールが13-cis へと光異性化した後、細胞外側領域に存在すると推定されるβ シートにまで構造変化が伝播している可能性を示唆する結果である。残念ながらMRの機能は未知であるが、このような特異な構造変化は11-cis 型レチナールを許容するMR の特異な分子特性を反映したものではないかと考えている。
イオンチャネルは、生体電気信号の源であり、様々な細胞とりわけ神経細胞が機能するために重要な役割を果たす膜タンパク質である。カリウムチャネルはカリウムイオン(K+)を選択的に透過するが、それはイオン選択フィルターと呼ばれる領域において、主鎖のカルボニル基がK+ を配位するのに適した構造を構築しているためと考えられている。そこで、K+ もしくはナトリウムイオン(Na+)を結合した際の微細な構造の違いを明らかにするために、全反射赤外分光装置を用いて、イオン交換誘起の赤外差分光計測を行った。その結果、イオン選択フィルター近傍の主鎖に由来するamide I バンドの計測に成功した(図4)。K+ を配位した方がamide I バンドの振動数が高く、K+を8 個のカルボニル基で配位した構造であると考えると矛盾しないことが分かった。K+ 濃度を変化させることで、K+ の親和性の指標となる解離定数は約10 mM 程度であることもわかった。また、低K+ 濃度ではフィルター構造に変化が生じていることも見いだした[9]。さらに各種アルカリ金属イオンとの赤外差スペクトルを計測することにより、KcsA はリチウムイオン(Li+)とNa+とで似たような相互作用をし、K+、ルビジウムイオン(Rb+)、セシウムイオン(Cs+)とも似たような相互作用をするが、両グループ間では異なる相互作用であることを明らかにした[10]。現在、さらに研究を発展させるために、ほ乳動物由来のカリウムチャネルにも本手法を適用し、カリウムイオン選択機構について研究を進めている。
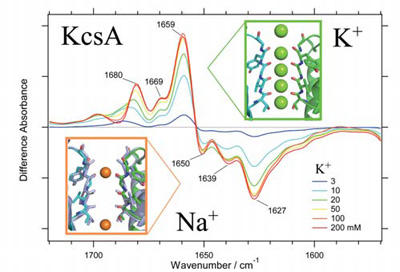
図4 カリウムチャネルKcsA のカリウムイオンとナトリウムイオンとの相互作用に伴う赤外吸収スペクトル変化
数ナノメートル程度の金薄膜を全反射赤外分光用のプリズム表面に作製することで、金薄膜に吸着した分子種の赤外吸収強度を増強することが可能である。このような表面増強赤外分光計
測を膜タンパク質に適用するため、金薄膜の厚みの違いによる赤外吸収への影響を調べた。対象にはハロロドプシン試料を選び、タンパク質骨格の吸収を反映するamide I およびamide II を観測した。その結果、厚みが3~7 nm 程度では通常の吸収スペクトルが観測され、9-11 nm ではスペクトルに歪みが現れ、~20 nm においては正負が逆転したスペクトルを観測した。偏光子を用いた計測により、スペクトル形状の変化はs 偏光による影響であることを明らかにした[11]。
膜タンパク質のカリウムチャネルのモデル系として、本手法をK+ を選択的に吸着するイオノフォア有機分子であるクラウンエーテルに適用し、各種アルカリ金属イオンを含む緩衝液と含まない緩衝液との赤外吸収差スペクトルを計測した(図5)。その結果、K+、Rb+、Cs+ では似たような差スペクトルが得られたが、Li+、Na+ では異なる形状の差スペクトルが得られ、イオン吸着に伴う構造変化に差異があることが示唆された。本研究は、広島大学の井口佳哉博士(広島大学・准教授)が主導する共同研究として行われた[12,13]。
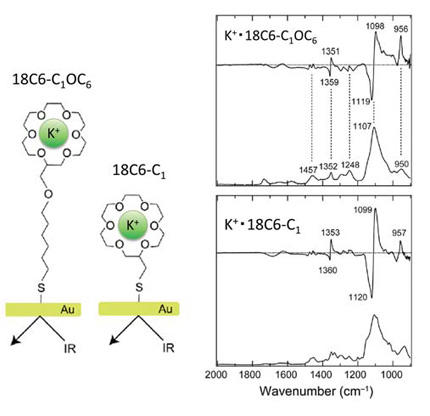
図5 クラウンエーテル(左)とカリウムイオンとの相互作用に伴う赤外吸収スペクトル変化(右)
膜タンパク質の機能発現機構を解明するためには、生体分子やイオンの結合・解離に伴う構造変化を時分割で解析する手法が必要である。
全反射赤外分光装置と圧縮空気作動型ポンプを組み合わせて、膜タンパク質試料を浸している緩衝液を急速に置換する手法を開発した。塩化物イオンや硝酸イオンを結合するハロロドプシンに対して本手法を適用し、そのイオン結合に伴う赤外吸収スペクトル変化の時分割計測に成功した[14, 15]。ステップスキャン法を用いることで、2.5 msでの時分割計測を行い、緩衝液交換が25 ms 程度で終了していることを硝酸イオンのNO 伸縮振動より確認した(図6)。さらに、ハロロドプシンのイオン取込み反応をレチナールのC=C 伸縮振動により追跡した。
また、藤貴夫准教授のグループが開発したチャープパルス上方変換による全反射赤外分光装置と組み合わせた実験も行った。全反射プリズム上の水とアセトンが置き換わる様子を1 ミリ秒の時間分解能で計測することに成功した。その結果、溶液交換が約10 ミリ秒で完結していることを確認した [16]。溶液交換速度の違いは流路の形状や全反射プリズムのサイズなどに依存するが、概ね10 ミリ秒程度が本手法での時間分解能の下限であると思われる。
このように本手法は、表面積の小さい全反射プリズムを用いた全反射赤外分光法と組み合わせることで、ごく少量(数μg 程度)の膜タンパク質試料でのイオンや基質との相互作用に関わる時間分解計測を可能にする手法である。今後は、様々なイオンチャネル、トランスポーター、イオンポンプ、受容体等に適用されることを期待している。
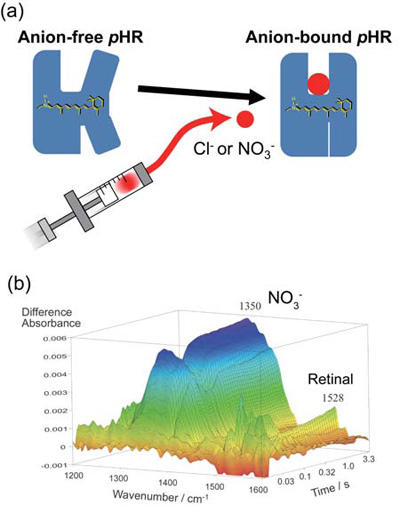 図6 急速溶液交換法によるハロロドプシンのイオン結合に伴う赤外吸収スペクトル変化
図6 急速溶液交換法によるハロロドプシンのイオン結合に伴う赤外吸収スペクトル変化
赤外分光法やラマン分光法などで得られる振動スペクトルは、「分子からの手紙」とも呼ばれている [17]。膜タンパク質のような巨大分子においても、様々な刺激の前後での差スペクトルを計測することで、特定のアミノ酸残基や水分子の構造情報や、その時間変化に関する情報を得ることが可能である。そのため、このような赤外差スペクトルは暗号化された断片的な手紙とも言える。膜タンパク質のような巨大分子からの手紙を読み解く作業は、生体分子系の赤外分光研究の難しさでもあり、醍醐味でもある。今後も赤外分光法はタンパク質の分子機構研究において、重要な役割を果たしていくものと考えている。現在、膜タンパク質に掛かる膜電位の効果を明らかにするため、新規計測系の構築を含め、研究を進めているところである。将来的には、膜タンパク質がより生理的環境に近い状況下でどのように動作するのかを明らかにしたいと考えている。
本稿で紹介した研究では、共同研究者の方々の他に、古谷グループのメンバー(木村哲就博士、塚本寿夫博士、稲熊あすみ博士、藤原邦代博士、Hao Guo 博士)がそれぞれ中心的な役割を果たしました。また、科学研究費助成事業(課題番号:26640047, 26708002 , 24650203 , 22770159 , 22018030, 22247024)、さきがけ研究(「光エネルギーと物質変換」領域)、森野基金等の支援を受けました。ここに感謝致します。
[1] 古谷祐詞「赤外分光法による膜タンパク質の分子機構研究」,Molecular Science 8, A0067, 2014
[2] 古谷祐詞「微生物型ロドプシンの光誘起イオン輸送メカニズムの解明」, オプトジェネティクス-光工学と遺伝学による行動制御技術の最前線-(NTS), 69-78, 2013
[3] Y. Furutani, Chapter 5 “Molecular Mechanisms for Ion Transportation of Microbial Rhodopsins Studied by Light-Induced Difference FTIR Spectroscopy”, Optogenetics -Light-Sensing Proteins and Their Applications- (Eds.: H. Yawo, H. Kandori, A. Koizumi), Springer, 2015
[4] Y. Furutani and H. Kandori, “Hydrogen-Bonding Changes of Internal Water Molecules upon the Actions of Microbial Rhodopsins Studied by FTIR Spectroscopy”, Biochim. Biophys. Acta 1837 (5), 598-605, 2014
[5] H. Kandori, Y. Furutani and T. Murata, “Infrared Spectroscopic Studies on the V-ATPase”, Biochim. Biophys. Acta 1847 (1), 134-141, 2015
[6] Y. Furutani, K. Fujiwara, T. Kimura, T. Kikukawa, M. Demura and H. Kandori, “Dynamics of Dangling Bonds of Water Molecules in pharaonis Halorhodopsin during Chloride Ion Transportation”, J. Phys. Chem. Lett. 3, 2964-2969, 2012
[7] A. Inaguma, H. Tsukamoto, H. E. Kato, T. Kimura, T. Ishizuka, S. Oishi, H. Yawo, O. Nureki and Y. Furutani, “Chimeras of Channelrhodopsin-1 and -2 from Chlamydomonas reinhardtii Exhibit Distinctive Light-Induced Structural Changes from Channelrhodopsin-2”, J. Biol. Chem. 290 (18), 11623-11634, 2015
[8] Y. Furutani, T. Okitsu, L. Reissig, M. Mizuno, M. Homma, A. Wada, Y. Mizutani, and Y. Sudo, “Large Spectral Change Due to Amide Modes of a β-Sheet upon the Formation of an Early Photointermediate of Middle Rhodopsin”, J. Phys. Chem. B, 117 (13), 3449-3458, 2013
[9] Y. Furutani, H. Shimizu, Y. Asai, T. Fukuda, S. Oiki and H. Kandori, “ATR-FTIR Spectroscopy Revealed the Different Vibrational Modes of the Selectivity Filter Interacting with K+ and Na+ in the Open and Collapsed Conformations of the KcsA Potassium Channel”, J. Phys. Chem. Lett. 3, 3806-3810, 2012
[10] Y. Furutani, H. Shimizu, Y. Asai, S. Oiki and H. Kandori, “Specifi c Interactions between Alkali Metal Cations and the KcsA Channel Studied Using ATR-FTIR Spectroscopy”, Biophys. Physicobiol. 12, 37-45, 2015.
[11] H. Guo, T. Kimura, Y. Furutani, “Distortion of the Amide-I and -II Bands of an α-helical Membrane Protein, pharaonis Halorhodopsin, Depends on Thickness of Gold Films Utilized for Surface-Enhanced Infrared Absorption Spectroscopy”, Chem. Phys. 419, 8-16, 2013
[12] Y. Inokuchi, T. Mizuuchi, T. Ebata, T. Ikeda, T. Haino, T. Kimura, H. Guo, Y. Furutani, “Formation of Host-Guest Complexes on Gold Surface Investigated by Surface-Enhanced IR Absorption Spectroscopy”, Chem. Phys. Lett. 592, 90-95, 2014
[13] Y. Inokuchi, T. Ebata, T. Ikeda, T. Haino, T. Kimura, H. Guo, and Y. Furutani, “New Insights into Metal Ion-Crown Ether Complexes Revealed by SEIRA Spectroscopy”, New J. Chem. in press (DOI:10.1039/C5NJ01787D).
[14] Y. Furutani, T. Kimura and K. Okamoto, “Development of a Rapid Buffer-Exchange System for Time-Resolved ATR-FTIR Spectroscopy with the Step-Scan Mode”, BIOPHYSICS, 9, 123-129, 2013
[15] 古谷祐詞,木村哲就,岡本基土「急速緩衝液交換法による時間分解全反射赤外分光法の開発」,生物物理 54 (5), 272-275, 2014
[16] H. Shirai, C. Duchesne, Y. Furutani, and T. Fuji, “Attenuated Total Refl ectance Spectroscopy with Chirped-Pulse Upconversion”, Opt. Express 22 (24), 29611-29616, 2014
[17] 濵口宏夫「分子科学の「ときめき度」」,分子研レターズ65, 1, 2012