サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報

現在人類が直面しているエネルギー・環境問題を背景に、太陽光のエネルギーを貯蔵可能な化学エネルギーへと変換する人工光合成技術の開発が期待されている。私たちは、人工光合成を実現する上で障害の一つとなっている酸素発生触媒の開発を目指し、生体機能の中心的な役割を果たしている金属錯体に注目した触媒開発研究を推進している。本稿では、私たちが最近報告した鉄五核錯体の酸素発生触媒作用に関する研究[1]を紹介したい。
植物が行う光合成では、二酸化炭素が還元され炭水化物が合成されるのと同時に、水を酸化して酸素が作られている。後者の「水の酸化による酸素発生」は、炭水化物(化学エネルギー)の生産とあまり関係が無いようである。しかし実際には、この酸素発生反応(2H2O → O2 + 4H+ + 4e-)により得られる電子(e-)が二酸化炭素を還元し、炭水化物を生産している。すなわち、酸素発生反応は、光合成の化学エネルギー生産において「電子の供給」という極めて大きな役割を担っている。この酸素発生反応は、人工光合成の達成にむけても不可欠なプロセスであり、優れた触媒の開発が求められる。しかし、高い活性・耐久性を兼ね備えた酸素発生触媒の開発は現在でも極めて困難であり、人工光合成システムの構築におけるボトルネックであるとされてきた。
酸素発生反応(2H2O → O2 + 4H+ + 4e-)は、2種類の大きく異なる反応の連続的な進行によって起きる。それは、4つの電子が移動する「多電子移動反応」と2つの水分子から1分子の酸素分子を発生させる「酸素―酸素結合生成反応」である。酸素発生反応を効率よく進行させるには、これら2つの反応を共に高効率化させる必要がある。
天然の光合成反応では、酸素発生錯体(Oxygen Evolving Complex、OEC)と呼ばれる金属錯体が多電子移動反応と酸素―酸素結合生成反応の効率化に貢献している。2011年に岡山大学の沈建仁教授、大阪市立大学の神谷信夫教授らのグループにより明らかにされたOECの詳細な構造を図1に示す[2]。OECは4つのMnイオンと1つのCaイオンが酸素原子で架橋された多核構造を有する。この多核構造が、酸素発生に必要な電荷を蓄積し、スムーズな多電子移動反応に貢献している。そこで我々は、多電子移動反応を促進するための鍵はこの「多核構造」にあると考えた。次に、OECにおける酸素―酸素結合生成反応について考察を行った。OECの酸素―酸素結合生成メカニズムはまだ完全には解明されていないが、近年の研究成果により、Mn3に結合したO5とMn1に配位した水分子との間で酸素―酸素結合生成が起きる可能性が高いとされている[3,4]。このとき、結合生成反応を起こす2つの酸素原子は非常に近接した距離に存在し、酸素―酸素結合生成反応を促進している。すなわち、酸素―酸素結合生成反応促進の鍵は「近接した水分子の結合サイト」にあると予想される。
以上の考察に基づき、我々は図 2に示す鉄五核錯体(1)を酸素発生触媒として用いることとした。1は5つの鉄イオンと6つの有機配位子ならびに1つの架橋酸素原子からなる「多核構造」を持つ。5つの鉄イオンのうち中央に存在する3つは、水分子が結合することが可能な配位不飽和構造であり、またこれらの金属イオンは互いに近い距離にある。つまり、「近接した水分子の結合サイト」が存在する。また、金属イオンとして用いられた鉄イオンは、酸素原子との親和性が高く、水分子と迅速に結合すると予想される。鉄は遷移金属の中で最も地殻存在量が多く(5%)[5]、価格も安い(1 kg当り5円)ため[6]、資源としての利用し易さという観点からも魅力的である。
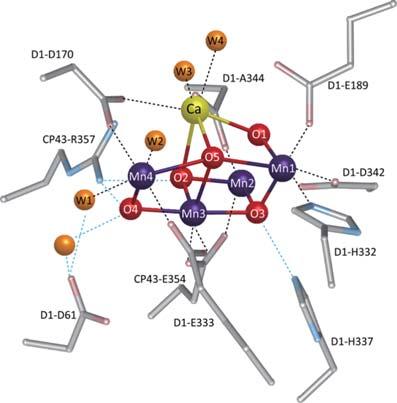 図1.天然の光合成反応における酸素発生錯体(OEC)の構造。Wは水分子の酸素原子。
図1.天然の光合成反応における酸素発生錯体(OEC)の構造。Wは水分子の酸素原子。
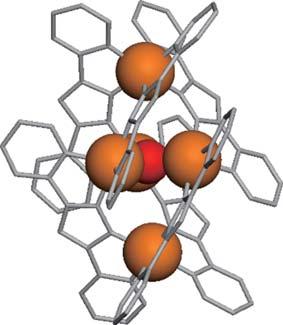 図 2.鉄5核錯体触媒(1)の分子構造。5つのオレンジ色の球体が鉄イオンであり、周囲に存在する有機配位子(灰色)により安定化されている。
図 2.鉄5核錯体触媒(1)の分子構造。5つのオレンジ色の球体が鉄イオンであり、周囲に存在する有機配位子(灰色)により安定化されている。
1のアセトニトリル中でのサイクリックボルタモグラム(CV)測定の結果を図3aに示す。還元側に1つ(-0.55 V vs. Fc+/Fc)、酸化側に4つ(0.13, 0.30, 0.68, 1.08 V)の可逆な酸化還元波が観測され、これらは1に存在する5つの鉄イオンが逐次的にII価からIII価へと酸化される過程に相当する。ここで酸化側の反応に着目すると、FeII4FeIII状態(S0)から4段階の電子移動反応を経て4電子酸化体(S4)が生成する。酸素発生反応は水からの4電子放出により起こるため、水からS4に4電子を渡すことができれば、酸素発生反応は進行しうる(図 3b)。そこで水存在下で1のCV測定を行ったところ、S4の生成に伴って触媒電流と呼ばれる不可逆な大きな電流の立ち上がりが観測された(図 3c, 赤線)。触媒電流は、電気化学反応によって生じた酸化種が化学反応により還元種へと変換され、生成した還元種が再び酸化種へと酸化されるサイクルが連続的に起きることによって生じるため、電気化学的な触媒反応の進行を示唆する。
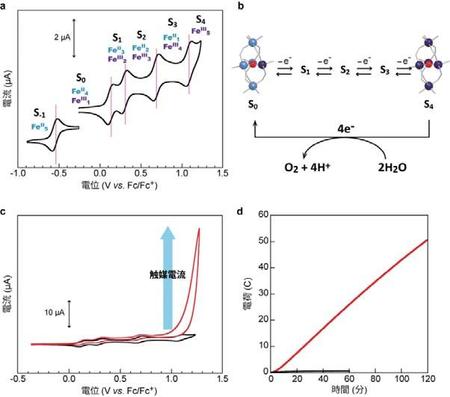 図 3.(a) 1のアセトニトリル溶液中におけるサイクリックボルタモグラム。(b) 1の酸化による4電子体の生成と、想定される水との反応。水色の球はFeIIイオン、紫色の球はFeIIIイオンを表す。(c) 1 のアセトニトリル溶液中における5 Mの水添加時(赤線)ならびに水非添加時(黒線、図3aと同一のデータ)のサイクリックボルタモグラム。(d)アセトニトリル/水混合溶媒(10:1)中での定電位電解実験における電荷量の時間変化。赤線は1存在下、黒線は1非存在下でのデータ。文献1より改変
図 3.(a) 1のアセトニトリル溶液中におけるサイクリックボルタモグラム。(b) 1の酸化による4電子体の生成と、想定される水との反応。水色の球はFeIIイオン、紫色の球はFeIIIイオンを表す。(c) 1 のアセトニトリル溶液中における5 Mの水添加時(赤線)ならびに水非添加時(黒線、図3aと同一のデータ)のサイクリックボルタモグラム。(d)アセトニトリル/水混合溶媒(10:1)中での定電位電解実験における電荷量の時間変化。赤線は1存在下、黒線は1非存在下でのデータ。文献1より改変
次にこの触媒反応の反応生成物の定量分析を行った。1を含む電解質溶液に触媒反応が十分進行する電圧(1.42 V vs. Fc+/Fc)を印加し、電圧印加中に流れた電流値を観測した(図3d)。その結果、反応終了後の気相から生成物である酸素が検出された。酸素発生反応の電流変換効率が96%と非常に高い値であったことから、1が酸素発生反応を選択的に進行させる触媒であることが確認された。更に、この酸素発生反応の触媒回転頻度(TOF)を算出したところ、TOF = 1,900 s-1となった。この値は、既存の鉄錯体触媒と比較して1,000倍以上大きなものであった[7-10]。反応条件が異なるため厳密な比較は難しいものの、植物の光合成における酸素発生反応速度(100-400 s-1 [11])をも上回っていた。
実験・計算科学的手法を用い、反応機構の解明を目指した。電気化学測定の結果から、1は最安定状態であるS0状態から4段階の電気化学反応によりS4を形成し、S4が形成されて始めて水分子と反応すると考えられる(図 3c)。量子化学計算を用いて検討した結果、S4への水侵入反応に必要な活性化エネルギーは15 kcal/mol程度と見積もられ、室温で十分にS4と水との反応が起きうることを示した(図 4)。引き続く反応としては、水配位体(A)への更なる水分子の配位ならびに脱プロトン反応によるオキソ種の生成が考えられる。オキソ種の最安定な電子状態を求めたところ、反応に伴い分子内電子移動反応が進行し、混合原子価状態を有するオキソ種Bが生成することが示唆された。また、Bからの分子内酸素―酸素結合生成(B→C)に必要な活性化エネルギーは、10 kcal/mol未満となり、隣接する水の結合サイト間での迅速な酸素―酸素結合生成反応の進行を強く示唆するものであった。すなわち、1を用いた酸素発生反応においては、「多核構造」と「近接した水分子の結合サイト」が酸素発生速度の向上に大きく寄与していることが実証された。
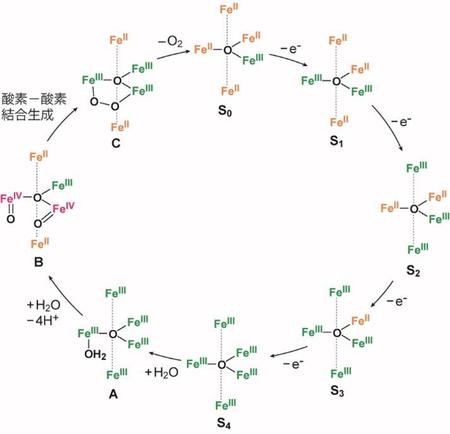 図4.1により触媒される酸素発生反応の推定反応機構。文献1より改変。
図4.1により触媒される酸素発生反応の推定反応機構。文献1より改変。
本研究成果は、人工光合成を実現するための障害とされてきた、水の分解による酸素発生反応を高効率で進行させる触媒を人工的に開発することに成功したものであり、人工光合成技術の進展に向けた大きな一歩である。さらに、「多核構造」と「隣接する水の結合サイト」に注目した触媒分子のデザイン戦略は、人工光合成の反応を含めた物質変換反応における触媒開発に重要な指針を与えうるものである。今後、触媒分子をさらに最適化することにより、エネルギーや環境問題の解決に貢献する高性能な触媒の開発につながると期待される。
本稿で紹介した研究は、分子科学研究所の岡村将也特任助教、近藤美欧助教、久我れい子氏、柳井毅准教授、倉重佑輝助教(現神戸大学准教授)、Pranneth K. K. Vijayendran博士、吉田将己博士(現北海道大学助教)、熊本大学の速水真也教授、佐賀大学の米田宏助教、福岡大学の川田知教授らとの共同研究の成果である。なお本研究はJSTさきがけ「光エネルギーと物質変換」、ACT-C「低エネルギー、低環境負荷で持続可能なものづくりのための先導的な物質変換技術の創出」、ならびにJSPS新学術領域研究「人工光合成による太陽光エネルギーの物質変換:実用化に向けての異分野融合」の研究助成を受けて行われた。関係者一同に深く感謝申し上げる。
[1] M. Okamura, M. Kondo, R. Kuga, Y. Kurashige, T. Yanai, S. Hayami, V. K. K. Praneeth, M. Yoshida, K. Yoneda, S. Kawata, S. Nature, 530, 465 (2016).
[2] Y. Umena, K. Kawakami, J.-R. Shen, N. Kamiya, Nature, 473, 55 (2011).
[3] N. Cox, D. A. Pantazis, F. Neese, W. Lubitz, Acc. Chem. Res., 46 (7), 1588 (2013).
[4] N. Cox, M. Retegan, F. Neese, D. A. Pantazis, A. Boussac, W. Lubitz, Science, 345, 804 (2014).
[5] F. W. Clarke and H. S. Washington, The composition of the Earth's crust, (1924).
[6] http://www.japanmetal.com/iron-steel-price.
[7] W. C. Ellis, N. D. McDaniel, S. Bernhard, T. J. Collins, J. Am. Chem. Soc., 132, 10990 (2010).
[8] J. L. Fillolet al., Nature Chem., 3, 807 (2011).
[9] D. Hong, et al., Inorg. Chem., 52, 9522 (2013).
[10] M. K. Coggins, M.-T. Zhang, A. K. Vannucci, C. J. Dares, T. J. Meyer,J. Am. Chem. Soc. 136, 5531 (2014).
[11] G. C. Dismukes et al.,Acc. Chem. Res., 42, 1935 (2009).